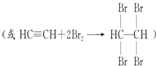
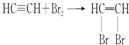题目内容
2.下列说法中正确的是( )| A. | 金刚石的能量比石墨高,因此金刚石比石墨更稳定 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
分析 A.物质具有的能量越高,其稳定性越弱;
B.化学反应的实质是旧化学键断裂,新化学键的形成过程;
C.浓硫酸溶于水没有新的物质生成;
D.木炭燃烧时放出热量,为放热反应.
解答 解:A.金刚石的能量比石墨高,则金刚石不如石墨稳定,故A错误;
B.化学反应的实质是旧化学键断裂,新化学键的形成过程,一定伴随能量变化,则化学反应中的能量变化主要是由化学键变化引起的,故B正确;
C.吸热反应和放热反应都属于化学变化,而浓硫酸溶于水没有新的物质生成,属于物理变化,故C错误;
D.木炭需加热到一定温度达到木炭的着火点时才燃烧,木炭燃烧时放出热量,故D错误;
故选B.
点评 本题考查反应热与焓变的应用,题目难度不大,明确物质稳定性与具有能量的关系为解答关键,C为易错点,注意吸热反应和放热反应都属于化学变化,试题侧重考查学生的灵活应用能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
10.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | 金刚石的熔点低于石墨 | 金刚石是原子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
11.几种短周期元素的原子半径及主要化合价如表:
下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | Y的氢化物的水溶液可用于雕刻玻璃 | |
| C. | X、Y、Z、M的单质分别与水反应,Y最剧烈 | |
| D. | R的最高价氧化物的水化物能与其气态氢化物反应生成盐 |
8.下列因素能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
| A. | CH3COOH | B. |  | C. | 升高温度 | D. | Ba2+ |
14.下列性质的递变规律正确的是( )
| A. | NaOH、KOH、CsOH碱性依次减弱 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Li、Na、K、Rb、Cs的最外层电子数依次减小 | |
| D. | Li、Na、K、Rb、Cs电子层数相同 |
11.关于化合物的下列说法中正确的是( )
| A. | 熔化状态下不导电的化合物一定是共价化合物 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | 由两种不同的原子组成的纯净物一定是化合物 | |
| D. | 不含非极性键的晶体一定是共价化合物 |
 表示的分子式为C6H14;
表示的分子式为C6H14; 中含有的官能团的名称为羟基、酯基;
中含有的官能团的名称为羟基、酯基;