题目内容
4.下列离子方程式正确的是( )| A. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2 OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ |
分析 A.过量铁粉和浓硝酸在加热条件下反应生成硝酸亚铁;
B.漏写生成氢氧化铜的离子反应方程式;
C.等体积等浓度的Ba(OH)2和NH4HCO3混合,OH-和NH4+、HCO3-恰好完全反应,生成碳酸钡沉淀和一水合氨、水;
D.电荷不守恒、转移电子不守恒.
解答 解:A.过量铁粉和浓硝酸在加热条件下反应生成硝酸亚铁,离子方程式为Fe+2NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++2NO2↑+3H2O,故A错误;
B.漏写生成氢氧化铜的离子反应方程式,离子方程式为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故B错误;
C.等体积等浓度的Ba(OH)2和NH4HCO3混合,OH-和NH4+、HCO3-恰好完全反应,生成碳酸钡沉淀和一水合氨、水,离子方程式为Ba2++2 OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O,故C正确;
D.电荷不守恒、转移电子不守恒,离子方程式为2Fe3++Cu═2Fe2++Cu2+,故D错误;
故选C.
点评 本题考查离子方程式正误判断,为高频考点,明确离子方程式书写规则及物质性质是解本题关键,涉及氧化还原反应、复分解反应,注意A中产物与反应物的量有关,常温下浓硝酸和Fe发生钝化现象但加热条件下发生反应,易错选项是B.

练习册系列答案
相关题目
15.在c(NH4+)=0.1mol•L-1的NH4Fe(SO4)2溶液中,下列各组离子能大量共存的是( )
| A. | H+、Ba2+、Br-、I- | B. | K+、Na+、CO32-、OH- | ||
| C. | Cu2+、Al3+、Cl-、NO3- | D. | Ca2+、Mg2+、CH3COO-、SCN- |
12.下列说法不正确的是( )
| A. | 2H2表示的是2个氢气分子 | |
| B. | 4Cl-表示的是4个氯离子,每个氯离子带一个单位负电荷 | |
| C. | 3O表示的是3个氧元素 | |
| D. | 42Ca表示钙原子的质量数为42,质子数为20 |
19.下列实验事实不能用勒夏特列原理解释的是( )
| A. |
| |||||||||
| B. |
| |||||||||
| C. | 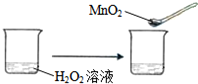 | |||||||||
| D. | 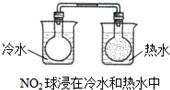 |
9.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 氨水应密闭保存于低温处 | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)═2NH3(g)△H<0 |
16.下列说法不正确的是 ( )
| A. | 含0.1mol H2SO4的浓硫酸与含0.2 mol NaOH的溶液混合,放出的热量即为中和热 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 增大反应物的浓度,可增加单位体积内活化分子数,从而使反应速率增大 | |
| D. | 为了防止轮船的钢铁外壳被腐蚀,可以在外壳上连接锌块 |
13.下列选项中,表示ⅥA族某元素原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列化学用语表述正确的是( )
| A. | 甲烷的球棍模型: | B. | 氯化氢的电子式: | ||
| C. | Cl2的结构式:Cl=Cl | D. | 硫离子的结构示意图: |