题目内容
实验室用高锰酸钾与浓盐酸反应制取Cl2:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)该反应的氧化剂是 ,氧化产物是 ;
(2)当有15.8g KMnO4参加反应时,被氧化的还原剂有 mol,标况下生成Cl2的体积为 L,转移电子的数目为 .
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)该反应的氧化剂是
(2)当有15.8g KMnO4参加反应时,被氧化的还原剂有
考点:氧化还原反应
专题:氧化还原反应专题
分析:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,以此来解答.
解答:
解:(1)因Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高被氧化,则对应的Cl2为氧化产物,故答案为:KMnO4;Cl2;
(2)n(KMnO4)=
=0.1mol,得到电子为0.1mol×5=0.5mol,则被氧化的还原剂HCl为
=0.5mol,转移电子数目为0.5NA,生成氯气为0.25mol,其体积为0.25mol×22.4L/mol=5.6L,故答案为:0.5;5.6;0.5NA.
(2)n(KMnO4)=
| 15.8g |
| 158g/mol |
| 0.5mol |
| [0-(-1)] |
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
一定温度下,氯化银在水中存在溶解平衡 AgCl(s)?Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中.搅拌后在相同的温度下Ag+浓度由大到小的顺序是( )
| A、③>①>②>④ |
| B、②>①>④>③ |
| C、④>③>②>① |
| D、①>③>④>② |
通过NOx传感器可监测NOx的含量,其工作原理示意图如图,下列说法正确的是( )
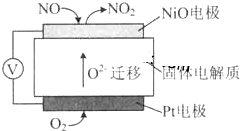

| A、NiO电极是该电池的正极 |
| B、Pt电极附近的pH增大 |
| C、NiO电极的电极反应式:NO-2e-+O2-═NO2 |
| D、固体电解质中O2-向正极移动 |
下列属于水解离子方程式且正确的是( )
| A、NH3+H2O?NH4++OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、HCO3-+H2O?H3O++CO32- |
 难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(g)+2I2(g)
难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(g)+2I2(g)| 1123K |
| 1023K |
| A、在不同温度区域,TaI4的量不同 |
| B、在提纯过程中,S2的量不断增多 |
| C、该反应的平衡常数不随TaI4和S2的浓度增大而增大 |
| D、在提纯过程中,I2的作用是将TaS2从高温区转移到低温区 |
下列反应的离子方程式书写正确的是( )
| A、稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | ||
| B、Cl2与水的反应:Cl2+H2O=2 H++Cl-+ClO- | ||
C、(NH4)2SO4溶液中加入Ba(OH)2:Ba2++SO
| ||
| D、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |