题目内容
 已知25℃、101kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.
已知25℃、101kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.(1)0.1mol甲烷和0.2mol氢气组成的混合气体在25℃、101kPa下完全燃烧释放的热量为
(2)写出表示葡萄糖燃烧热的热化学方程式:
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:a极:
若使用碱性电解质溶液,则b极的电极反应式为:b极:
放电时电极a作
电解质溶液中阳离子移向
考点:热化学方程式,原电池和电解池的工作原理
专题:电化学专题
分析:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据甲烷和氢气的物质的量求出放出的热量;
(2)根据燃烧热的定义书写热学方程式;
(3)酸性条件下,b电极上为甲烷失电子生成二氧化碳;碱性条件下,b电极上为甲烷失电子生成碳酸根离子;通入氧气的一极为正极,电流从正极流向负极,阳离子向正极移动.
(2)根据燃烧热的定义书写热学方程式;
(3)酸性条件下,b电极上为甲烷失电子生成二氧化碳;碱性条件下,b电极上为甲烷失电子生成碳酸根离子;通入氧气的一极为正极,电流从正极流向负极,阳离子向正极移动.
解答:
解:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,已知0.1mol甲烷和0.2mol氢气,则混合气体完全燃烧释放的热量为:0.1mol×890.3kJ/mol+0.2mol×285.8kJ/mol=146.19kJ;
故答案为:146.19kJ;
(2)已知葡萄糖的燃烧热为2800kJ/mol,则葡萄糖燃烧热的热化学方程式为:C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)△H=-2800kJ/mol;
故答案为:C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)△H=-2800kJ/mol;
(3)酸性条件下,a极上氧气放电生成水,其电极反应式为:2O2+8H++8e-═4H2O;b电极上为甲烷失电子生成二氧化碳,其电极反应式为:CH4+2H2O-8e-═CO2+8H+;
碱性条件下,b电极上为甲烷失电子生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;
通入氧气的一极为正极,所以a为正极,电流从正极流向负极即外电路中电流从a极流向b极,电解质溶液中的阳离子向a极移动;
故答案为:2O2+8H++8e-═4H2O;CH4+2H2O-8e-═CO2+8H+;CH4+10OH--8e-═CO32-+7H2O; 正;a;b;a.
故答案为:146.19kJ;
(2)已知葡萄糖的燃烧热为2800kJ/mol,则葡萄糖燃烧热的热化学方程式为:C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)△H=-2800kJ/mol;
故答案为:C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)△H=-2800kJ/mol;
(3)酸性条件下,a极上氧气放电生成水,其电极反应式为:2O2+8H++8e-═4H2O;b电极上为甲烷失电子生成二氧化碳,其电极反应式为:CH4+2H2O-8e-═CO2+8H+;
碱性条件下,b电极上为甲烷失电子生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;
通入氧气的一极为正极,所以a为正极,电流从正极流向负极即外电路中电流从a极流向b极,电解质溶液中的阳离子向a极移动;
故答案为:2O2+8H++8e-═4H2O;CH4+2H2O-8e-═CO2+8H+;CH4+10OH--8e-═CO32-+7H2O; 正;a;b;a.
点评:本题考查了燃烧热的概念、热化学方程式的书写、原电池原理的应用及电极方程式的书写,属于基本原理的考查,掌握不同条件下的电极反应是解题的关键,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
只用氢氧化钠溶液不能除去下列各组物质中的杂质(括号中是杂质)的是( )
| A、Mg(Al2O3) |
| B、MgCl2(AlCl3) |
| C、Mg(Al) |
| D、MgO(Al2O3) |
1mol某有机物在稀硫酸作用下,水解生成2摩相同的物质.下列物质中:①蔗糖 ②麦芽糖 ③淀粉④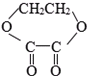 ⑤
⑤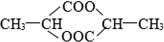 ⑥
⑥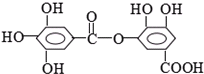
符合题意的物质可能是( )
 ⑤
⑤ ⑥
⑥
符合题意的物质可能是( )
| A、①②⑤ | B、②④⑤ |
| C、②⑤⑥ | D、①④⑤⑥ |
将0.3mol硝酸银、0.6mol硝酸铜、0.7mol氯化钾溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.4mol铜,此时在另一极上产生的气体体积(标准状况)为多少( )
| A、4.48L | B、5.6L |
| C、6.72L | D、8.96L |


