题目内容
11.不能说明金属性Na>Mg>Al的是( )| A. | 碱性NaOH>Mg(OH)2>Al (OH)3 | |
| B. | 原子半径Na>Mg>Al | |
| C. | 阳离子的氧化性Na+<Mg2+<Al3+ | |
| D. | Na与冷水剧烈反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈 |
分析 利用金属单质之间的置换反应、失去电子的难易程度、金属对应阳离子的氧化性、与水或酸反应的难易程度、金属的最高价氧化物对应水化物的碱性等来比较金属性的强弱.
解答 解:A.根据金属元素最高价氧化物对应水化物的碱性可以判断元素金属性的强弱,碱性NaOH>Mg(OH)2>Al (OH)3,能说明金属性Na>Mg>Al,故A正确;
B.元素金属性强弱与原子半径无关,所以不能根据原子半径判断金属性强弱,故B错误;
C.阳离子的氧化性越弱,其元素的金属性越强,阳离子的氧化性Na+<Mg2+<Al3+,能说明金属性Na>Mg>Al,故C正确;
D.Na能与冷水反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈,能说明金属性Na>Mg>Al,故D正确.
故选B.
点评 本题考查学生判断金属性强弱的依据,熟悉金属性比较的常见方法即可解答,侧重于基础知识的考查,题目难度不大

练习册系列答案
相关题目
1.下列有关烷烃的命名错误的是( )
| A. |  2甲基丁烷 2甲基丁烷 | B. |  2,2,4三甲基戊烷 2,2,4三甲基戊烷 | ||
| C. | (CH3CH2)2CHCH3 3甲基戊烷 | D. |  异戊烷 异戊烷 |
19.元素的性质呈周期性变化的根本原因是( )
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
6.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的bd(填代号).
a.CuO b.NaOH c.Cu d..Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl.•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴
入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.
(已知:2Cu2++4I-=2CuI↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.
(已知:I2+2S2O32-=2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液.
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
③该样品中CuCl2•2H2O 的质量分数为$\frac{171cV×1{0}^{-3}×10}{m}$×100%(用含m、c、V的代数式表示,不用化简).

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的bd(填代号).
a.CuO b.NaOH c.Cu d..Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl.•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴
入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.
(已知:2Cu2++4I-=2CuI↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.
(已知:I2+2S2O32-=2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液.
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
③该样品中CuCl2•2H2O 的质量分数为$\frac{171cV×1{0}^{-3}×10}{m}$×100%(用含m、c、V的代数式表示,不用化简).
16.下列说法错误的是( )
| A. | 元素的最高正价数一定等于其原子核外最外层电子数 | |
| B. | 原子序数为79的元素在第六周期第IB族 | |
| C. | 碱金属单质的熔、沸点从上到下递减 | |
| D. | 同周期从左到右,元素的金属性递减,非金属性递增 |
3.下列说法错误的是( )
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
20.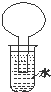 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后无变化 |
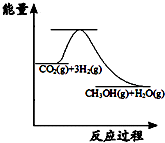 目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).
目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).