题目内容
 向500mL某碳酸钠溶液中逐滴加入1mol/L的盐酸,测得溶液中溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是 ( )
向500mL某碳酸钠溶液中逐滴加入1mol/L的盐酸,测得溶液中溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是 ( )| A、Oa段与ab段反应的离子方程式均为:CO32-+H+=HCO3- |
| B、该碳酸钠溶液的物质的量浓度为0.5mol/L |
| C、b点时,滴加盐酸的体积为600mL |
| D、b点时生成CO2的物质的量为0.3 mol |
考点:化学方程式的有关计算
专题:计算题
分析:将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,
A.根据发生的反应书写离子方程式;
B.a点全部生成碳酸氢钠,根据碳元素守恒计算n(Na2CO3),进而计算其物质的量浓度;
C.根据氯离子守恒计算n(HCl),再根据V=
计算消耗盐酸的体积;
D.根据碳元素守恒计算CO2的物质的量.
A.根据发生的反应书写离子方程式;
B.a点全部生成碳酸氢钠,根据碳元素守恒计算n(Na2CO3),进而计算其物质的量浓度;
C.根据氯离子守恒计算n(HCl),再根据V=
| n |
| c |
D.根据碳元素守恒计算CO2的物质的量.
解答:
解:将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,
A.Oa段反应的离子方程式与ab段反应的离子方程式分别为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,故A错误;
B.a点全部生成碳酸氢钠,从图象可知,碳酸氢根离子最大为0.5mol,根据碳元素守恒n(Na2CO3)=n(HCO3-)=0.5mol,故c(Na2CO3)=
=1mol/L,故B错误;
C.由图可知b点n(Cl-)=0.6mol,根据氯离子守恒n(HCl)=n(Cl-)=0.6mol,消耗盐酸的体积为
=0.6L=600mL,故C正确;
D.b点n(HCO3-)=0.4mol,根据碳元素守恒:n(CO2)=n(Na2CO3)-n(HCO3-)=0.5mol-0.4mol=0.1mol,故D错误,
故选C.
A.Oa段反应的离子方程式与ab段反应的离子方程式分别为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,故A错误;
B.a点全部生成碳酸氢钠,从图象可知,碳酸氢根离子最大为0.5mol,根据碳元素守恒n(Na2CO3)=n(HCO3-)=0.5mol,故c(Na2CO3)=
| 0.5mol |
| 0.5L |
C.由图可知b点n(Cl-)=0.6mol,根据氯离子守恒n(HCl)=n(Cl-)=0.6mol,消耗盐酸的体积为
| 0.6mol |
| 1mol/L |
D.b点n(HCO3-)=0.4mol,根据碳元素守恒:n(CO2)=n(Na2CO3)-n(HCO3-)=0.5mol-0.4mol=0.1mol,故D错误,
故选C.
点评:本题考查化学方程式阴极计算,关键是明确各阶段发生的反应,注意利用守恒法解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
| A、在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01 |
| B、室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)?c(OH-)]的比值变小,若加少量盐酸,则比值变大 |
| C、等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) |
| D、在相同温度下,K5>K4>K3 |
X、Y、Z是3种短周期元素,其中X、Y位于同一周期,Y、Z处于同一主族.X原子的最外层电子数是其核外电子总数的
倍.Z原子的最外层电子数比X少1.下列说法中不正确的是( )
| 3 |
| 4 |
| A、元素的非金属性由弱到强的顺序为:Z<Y<X |
| B、3种元素的最简单氢化物的沸点由高到低的顺序为:X>Z>Y |
| C、3种元素的原子半径由大到小的顺序为:Z>Y>X |
| D、Y元素的最高价氧化物的水化物与其最低价氢化物可以化合成盐 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )


| A、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
B、2NaHCO3
| ||||
C、4NH3+5O2
| ||||
| D、Zn+H2SO4═ZnSO4+H2↑ |
在溶液中能大量共存的一组离子或分子是( )
| A、NH4+、H+、NO3-、HCO3- |
| B、K+、Al(OH)4-、SO42-、NH3?H2O |
| C、Na+、K+、SO32-、ClO- |
| D、Na+、CH3COO-、SO42-、H+ |
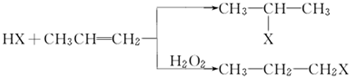
 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 ,现以苯酚和乙酸酐(
,现以苯酚和乙酸酐( )为有机原料,合成阿司匹林,请设计完成下列合成途径(合成路线常用的表示方法为:A
)为有机原料,合成阿司匹林,请设计完成下列合成途径(合成路线常用的表示方法为:A
 重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下:
重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下: