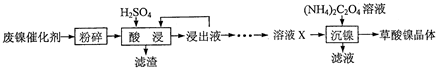
题目内容
铬铁矿主要成分为FeO?Cr2O3,含有SiO2、Al2O3等杂质.工业上用铬铁矿制备红矾钠(Na2Cr2O7)的流程如图所示:煅烧时反应为:4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O
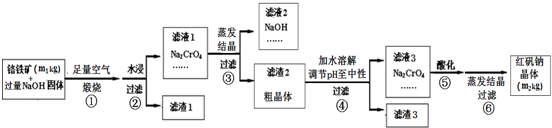
(1)步骤①是在坩埚中进行煅烧,可用作此坩埚材料的是 .
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)步骤①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因为 .
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,其化学方程式为 .
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表.根据数据分析,步骤③的最佳结晶温度为 .
(5)步骤④中滤渣3的成分是 .
(6)假设该流程中铬元素完全转化为红矾钠,则该铬铁矿中铬元素的质量分数为 (用含m1、m2的代数式表示).
| ||

(1)步骤①是在坩埚中进行煅烧,可用作此坩埚材料的是
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)步骤①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因为
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,其化学方程式为
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表.根据数据分析,步骤③的最佳结晶温度为
| 结晶温度/℃ | Na2CrO4粗晶中各物质含量/w% | |||
| Na2CrO4?4H2O | NaOH | Na[Al(OH)4] | Na2SiO3 | |
| 30 | 52.45 | 29.79 | 8.69 | 12.21 |
| 40 | 68.81 | 20.49 | 8.46 | 10.84 |
| 50 | 60.26 | 27.96 | 10.36 | 9.32 |
| 60 | 50.74 | 29.66 | 10.40 | 12.25 |
| 70 | 46.77 | 33.06 | 8.10 | 6.48 |
(6)假设该流程中铬元素完全转化为红矾钠,则该铬铁矿中铬元素的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:铬铁矿主要成分为FeO?Cr2O3,含有SiO2、Al2O3等杂质、混和NaOH(m1kg),与足量空气通过焙烧,4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解,三价铁水解,NaFeO2+2H2O=Fe(OH)3↓+NaOH,得固体氢氧化铁滤渣1和滤液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀;继续调节溶液的pH使CrO42-转化为Cr2O72-,Cr2O72-+H2O?2CrO42-+2H+,最后生成溶解度极小的Na2Cr2O7,得到红矾钠(Na2Cr2O7)(m2kg).
(1)根据步骤①在坩埚中进行煅烧物质含有强碱氢氧化钠,氢氧化钠能和二氧化硅反应来解答;
(2)根据影响化学反应速率的常见因素以及反应现象进行解答;
(3)NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH,据此书写化学方程式;
(4)根据五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,所得实验数据分析,步骤③的最佳结晶温度为40℃,此时Na2CrO4粗晶中得到的Na2CrO4?4H2O含量最高;
(5)步骤④为调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀,分离出Na2CrO4,据此分析解答;
(6)依据铬元素质量守恒,计算该铬铁矿中铬元素的质量分数;
| ||
(1)根据步骤①在坩埚中进行煅烧物质含有强碱氢氧化钠,氢氧化钠能和二氧化硅反应来解答;
(2)根据影响化学反应速率的常见因素以及反应现象进行解答;
(3)NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH,据此书写化学方程式;
(4)根据五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,所得实验数据分析,步骤③的最佳结晶温度为40℃,此时Na2CrO4粗晶中得到的Na2CrO4?4H2O含量最高;
(5)步骤④为调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀,分离出Na2CrO4,据此分析解答;
(6)依据铬元素质量守恒,计算该铬铁矿中铬元素的质量分数;
解答:
解:铬铁矿主要成分为FeO?Cr2O3,含有SiO2、Al2O3等杂质、混和NaOH(m1kg),与足量空气通过焙烧,4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解,三价铁水解,NaFeO2+2H2O=Fe(OH)3↓+NaOH,得固体氢氧化铁滤渣1和滤液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀;继续调节溶液的pH使CrO42-转化为Cr2O72-,Cr2O72-+H2O?2CrO42-+2H+,最后生成溶解度极小的Na2Cr2O7,得到红矾钠(Na2Cr2O7)(m2kg).
(1)A.铁坩埚含有铁,铁与氢氧化钠不反应,故A正确;
B.三氧化二铝能和氢氧化钠反应生成偏铝酸钠,故B错误;
C.石英中含有二氧化硅,二氧化硅能和氢氧化钠反应,故C错误;
D.陶瓷中含有二氧化硅,二氧化硅能和氢氧化钠反应,故D错误;
故选A.
(2)升高温度,增加单位体积内的活化分子数,有效碰撞增加,反应速率加快,需要升温至NaOH呈熔融状态,说明NaOH呈熔融状态,熔融后增大了反应物的接触面积,反应速率加快为主要因素,
故答案为:熔融后增大了反应物的接触面积;
(3)NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH,化学方程式为:NaFeO2+2H2O=Fe(OH)3↓+NaOH,
故答案为:NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(4)步骤③的目的:将滤液1在130℃蒸发1小时,冷却到结晶,比较所得实验数据,40℃,此时Na2CrO4粗晶中得到的Na2CrO4?4H2O含量最高,
故答案为:40;
(5)滤液1含有Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全转化为H2SiO3 (或H4SiO4 )沉淀,滤液为Na2CrO4,分离出Na2CrO4;
故答案为:Al(OH)3、H2SiO3 (或H4SiO4 );
(6)最终得到m2kg红矾钠(Na2Cr2O7),含铬n(Cr)=
×2,则该铬铁矿中铬元素的质量分数为:
×52=
,
故答案为:
;
| ||
(1)A.铁坩埚含有铁,铁与氢氧化钠不反应,故A正确;
B.三氧化二铝能和氢氧化钠反应生成偏铝酸钠,故B错误;
C.石英中含有二氧化硅,二氧化硅能和氢氧化钠反应,故C错误;
D.陶瓷中含有二氧化硅,二氧化硅能和氢氧化钠反应,故D错误;
故选A.
(2)升高温度,增加单位体积内的活化分子数,有效碰撞增加,反应速率加快,需要升温至NaOH呈熔融状态,说明NaOH呈熔融状态,熔融后增大了反应物的接触面积,反应速率加快为主要因素,
故答案为:熔融后增大了反应物的接触面积;
(3)NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH,化学方程式为:NaFeO2+2H2O=Fe(OH)3↓+NaOH,
故答案为:NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(4)步骤③的目的:将滤液1在130℃蒸发1小时,冷却到结晶,比较所得实验数据,40℃,此时Na2CrO4粗晶中得到的Na2CrO4?4H2O含量最高,
故答案为:40;
(5)滤液1含有Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全转化为H2SiO3 (或H4SiO4 )沉淀,滤液为Na2CrO4,分离出Na2CrO4;
故答案为:Al(OH)3、H2SiO3 (或H4SiO4 );
(6)最终得到m2kg红矾钠(Na2Cr2O7),含铬n(Cr)=
| m2×103g |
| 262g/mol |
| m2×103g×2 | ||
|
| 52m2 |
| 131m1 |
故答案为:
| 52m2 |
| 131m1 |
点评:本题考查了红矾钠制备流程和方案的分析判断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意物质性质的应用、题干信息的分析理解是解题关键,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列叙述中,正确的是( )
| A、石油、煤、天然气、氢气都属于化石燃料 |
| B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| C、人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 |
| D、两个体积相同的容器中充入等量的NO2发生反应:2NO2(g)?N2O4(g)△H<0,绝热容器中气体的颜色比恒温容器中颜色深 |
室温下,下列各组粒子在指定溶液中能大量共存的是( )
| A、Ba(NO3)2 溶液中:SO2、Na+、NH4+、CH3COO- |
| B、Kw/c(H+)=0.1mol/L-1的溶液中:K+、Ba2+、C1-、HCO3- |
| C、FeCl2溶液中:H2O2、Mg2+、H+、Cl- |
| D、含苯酚的水溶液中用::Al3+、NH4+、Br-、SO42- |
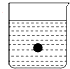 如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯中加入(或通入)下列物质后,小球沉到水底的是( )
如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯中加入(或通入)下列物质后,小球沉到水底的是( )| A、HCl |
| B、NH3 |
| C、浓H2SO4 |
| D、浓HNO3 |
只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,该试剂是( )
| A、BaCl2溶液 |
| B、FeCl2溶液 |
| C、FeCl3溶液 |
| D、Fe(NO3)3溶液 |
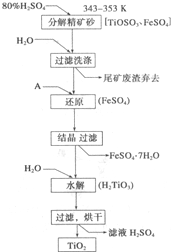 钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.如图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题:
钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.如图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题: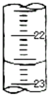 实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答:
实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答: