题目内容
16.高锰酸钾和浓盐酸可以发生下列反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O(1)在反应中,氧化剂是KMnO4氧化产物是Cl2,
二者氧化性的强弱顺序是:KMnO4>Cl2
(2)在反应中若有1mole-发生转移,则产生的气体体积在标准状况下是11.2 L.
分析 由方程式可知,反应中Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合化合价的变化以及反应的方程式计算.
解答 解:(1)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,化合价降低的Mn元素所在的反应物KMnO4是氧化剂,氧化剂的氧化性大于氧化产物的氧化性,则氧化性KMnO4>Cl2,
故答案为:KMnO4;Cl2; KMnO4;Cl2;
(2)Cl元素化合价由-1价升高到0价,由方程式可知,当生成5mol氯气时,转移10mol电子,如反应中转移了1mol电子,则产生0.5mol气体,体积为为0.5mol×22.4L/mol=11.2L,故答案为:11.2.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.乙烯、乙炔、邻二甲苯相比较,下列叙述不正确的是( )
| A. | 都能燃烧,生成 CO2 和 H2O | |
| B. | 邻二甲苯另有三种属于芳香烃的同分异构体 | |
| C. | 乙烯和乙炔易发生加成反应,邻二甲苯能发生取代反应 | |
| D. | 乙烯和乙炔易使酸性 KMnO4 溶液褪色,而邻二甲苯不能 |
11.下列物质中,所含分子数最多的是( )
| A. | 0.4mol H2 | B. | 8.8g CO2 | ||
| C. | 6.02×1022个CH4 | D. | 4.48L NH3(标准状况下) |
6. 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
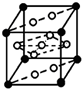 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
 ;
;