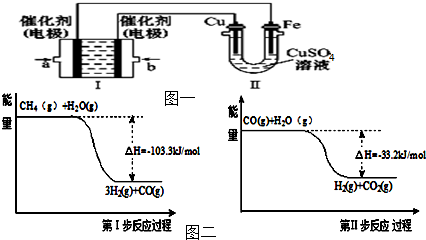
题目内容
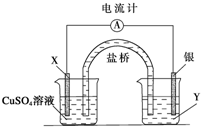 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:请回答下列问题:
(1)电极X的材料是
(2)银电极为电池的
X电极上发生的电极反应为
(3)外电路中的电子是从
考点:设计原电池,原电池和电解池的工作原理
专题:电化学专题
分析:该反应中,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液,以此解答该题.
解答:
解:(1)铜氧化,应为原电池负极,则正极为较铜更不活泼的金属,由装置图可知,银为正极,则X为负极,应为铜,电解质溶液Y是FeCl3,
故答案为:Cu;FeCl3;
(2)银为正极,发生还原反应,电极方程式为2Fe3++2e-=2Fe2+,X为正极,电极方程式为Cu-2e-=Cu2+,
故答案为:正;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;
(3)原电池工作时,电子从负极经导线流向正极,即从铜与流向银,故答案为:Cu;Ag.
故答案为:Cu;FeCl3;
(2)银为正极,发生还原反应,电极方程式为2Fe3++2e-=2Fe2+,X为正极,电极方程式为Cu-2e-=Cu2+,
故答案为:正;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;
(3)原电池工作时,电子从负极经导线流向正极,即从铜与流向银,故答案为:Cu;Ag.
点评:本题考查了原电池设计,根据方程式中得失电子的物质判断负极极电解质,方程式中失电子化合价升高的金属单质作负极,得电子化合价降低的化合物为其电解质.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
某温度下,C和H2O(g)在密闭容器里发生下列反应:
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,y的转化率为75% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数不变 |
| D、改变温度但不可以改变此反应的平衡常数 |
下列说法中正确的是( )
| A、增大反应物浓度,能增大活化分子百分数,所以反应速率增大 |
| B、使用正催化剂,能增大活化分子百分数,所以反应速率增大 |
| C、对于任何反应,增大压强都可加快反应速率 |
| D、升高温度,只能增大吸热反应的反应速率 |
再配制下列溶液时,引起误差偏低的是( )
| A、用500mL容量瓶配制450mL 0.1 moL/L的氢氧化钠溶液,用托盘天平称取氢氧化钠固体1.8g |
| B、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 |
| C、用量筒量取浓硫酸时,仰视读数 |
| D、其它环节正确,只是在定容时俯视容量瓶 |