题目内容
12.25℃、101kPa下,已知1g氢气完全燃烧生成液态水时放出142.9kJ的热量,表示氢气燃烧热的热化学方程式是2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ•mol-1.分析 1g氢气的物质的量为$\frac{1g}{2g/mol}$=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,结合物质的状态及焓变书写热化学方程式.
解答 解:1g氢气的物质的量为$\frac{1g}{2g/mol}$=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,则该反应的热化学方程式是2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ•mol-1,
故答案为:2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ•mol-1.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的量与热量的关系、热化学方程式的书写方法等为解答的关键,侧重分析与计算能力的考查,注意放热反应的焓变为负值,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
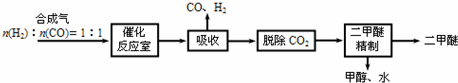
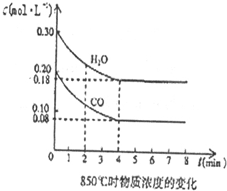
2.连二亚硫酸钠(Na2S2O4)在印刷工业中有重要的作用.某小组进行如下实验):
已知:①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O

I. 制备Na2S2O4
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置C中,然后通入SO2进行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2═2Na2S2O4+3CO2+H2O.
分析并回答下列问题:
(1)A中盛装浓硫酸的仪器名称是分液漏斗
(2)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; 冷却至 40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
(3)装置 D 盛放品红溶液,作用是检验装置C中SO2的吸收效率,若在吸收过程中D中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率.
II. Na2S2O4的性质
取纯净的Na2S2O4晶体,配成溶液,进行下列性质探究实验,完成如表的空格.
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2溶液)
III. 测定Na2S2O4的纯度
取8.00g制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固体0.64g.则 Na2S2O4的纯度为87%.[已知:M(Na2S2O4)=174.0g/mol].
已知:①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O

I. 制备Na2S2O4
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置C中,然后通入SO2进行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2═2Na2S2O4+3CO2+H2O.
分析并回答下列问题:
(1)A中盛装浓硫酸的仪器名称是分液漏斗
(2)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; 冷却至 40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
(3)装置 D 盛放品红溶液,作用是检验装置C中SO2的吸收效率,若在吸收过程中D中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率.
II. Na2S2O4的性质
取纯净的Na2S2O4晶体,配成溶液,进行下列性质探究实验,完成如表的空格.
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2溶液)
| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
取8.00g制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固体0.64g.则 Na2S2O4的纯度为87%.[已知:M(Na2S2O4)=174.0g/mol].
20.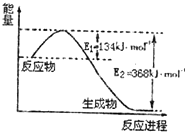 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
完成下列问题:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
1.反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
①反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
2.向某密闭容器中加入0.3molA、0.1molC 和一定量的 B 三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段 c ( B)未画出].附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
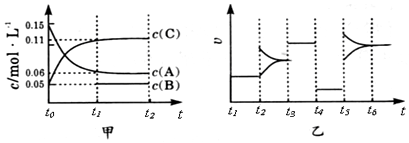

| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |