题目内容
2.连二亚硫酸钠(Na2S2O4)在印刷工业中有重要的作用.某小组进行如下实验):已知:①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O

I. 制备Na2S2O4
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置C中,然后通入SO2进行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2═2Na2S2O4+3CO2+H2O.
分析并回答下列问题:
(1)A中盛装浓硫酸的仪器名称是分液漏斗
(2)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; 冷却至 40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
(3)装置 D 盛放品红溶液,作用是检验装置C中SO2的吸收效率,若在吸收过程中D中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率.
II. Na2S2O4的性质
取纯净的Na2S2O4晶体,配成溶液,进行下列性质探究实验,完成如表的空格.
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2溶液)
| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
取8.00g制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固体0.64g.则 Na2S2O4的纯度为87%.[已知:M(Na2S2O4)=174.0g/mol].
分析 A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,据此书写;连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品.因为吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率,所以此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率.
(1)A 中盛装浓硫酸的仪器,可根据仪器结构分析;
(2)A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,据此书写;连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品;
(3)根据吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率;
II.【Na2S2O4 的性质】根据碱遇紫色石蕊试液变成蓝色,滴加过量新制氯水,再滴加 BaCl2溶液有白色沉淀生成,说明生成硫酸根,据此分析;
III.【测定 Na2S2O4的纯度】根据4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O,所以取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥得固 体 0.64g即为S单质质量,据此计算.
解答 解:(1)A 中盛装浓硫酸的仪器是分液漏斗,
故答案为:分液漏斗;
(2)A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,则化学方程式为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
连二亚硫酸钠易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,减少因溶解导致的损失,
故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;乙醇;
(3)因为吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率,所以此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率;故答案为:撤去A中酒精灯,减缓SO2的生成速率;
II.【Na2S2O4 的性质】因为碱遇紫色石蕊试液变成蓝色,所以取少量溶液于试管中,应滴加紫色石蕊试液;因为滴加过量新制氯水,再滴加 BaCl2溶液有白色沉淀生成,说明新制氯水将Na2S2O4 中 S 氧化生成硫酸根,硫酸根再与钡离子反应生成白色硫酸钡沉淀,离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+
,Ba2++SO42-=BaSO4↓;
故答案为:
| 假设 | 操作 | 现象 | 原理 |
| 紫色石蕊试液 | |||
| Na2S2O4具有还原性 | 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
故答案为:87%.
点评 本题考查物质制备和检验、实验设计与探究等,是对学生综合能力的考查,为高考常考题型,注意对题目信息的应用,难度中等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2O2与 H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 碳酸镁与稀盐酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填>、<或=).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定上述反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
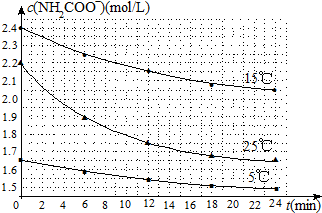
⑤计算25℃时,0~6min上述反应中氨基甲酸铵的平均速率0.05mol/(L•min).
⑥根据图中信息,如何说明上述反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.



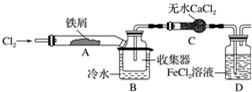 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: