题目内容
下列说法正确的是( )
| A、共价化合物中可能含有离子键 | ||||||
| B、Ca2+、K+、Cl-、S2-四种粒子的离子半径依次减小 | ||||||
C、
| ||||||
| D、第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱 |
考点:非金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较,质子数、中子数、核外电子数及其相互联系,质量数与质子数、中子数之间的相互关系,化学键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.共价化合物只含有共价键;
B.Ca2+、K+、Cl-、S2-四种离子核外电子排布相同,核电荷数越大,离子半径越小;
C.核外电子数等于质子数;
D.元素的非金属性越强,对应的氢化物越稳定.
B.Ca2+、K+、Cl-、S2-四种离子核外电子排布相同,核电荷数越大,离子半径越小;
C.核外电子数等于质子数;
D.元素的非金属性越强,对应的氢化物越稳定.
解答:
解:A.共价化合物只含有共价键,含有离子键,一定为离子化合物,故A错误;
B.Ca2+、K+、Cl-、S2-四种离子核外电子排布相同,核电荷数越大,离子半径越小,故B错误;
C.核外电子数等于质子数,都为84,故C错误;
D.非金属性O>S>Se,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选D.
B.Ca2+、K+、Cl-、S2-四种离子核外电子排布相同,核电荷数越大,离子半径越小,故B错误;
C.核外电子数等于质子数,都为84,故C错误;
D.非金属性O>S>Se,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选D.
点评:本题综合考查原子结构与元素周期律知识,为高频考点,侧重于基础知识的综合理解与运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
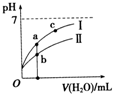 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| B、向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- |
| C、a、b、c三点所示溶液中水的电离程度c>a>b |
| D、图象中,I表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
下列说法正确的是( )
| A、苯中含有杂质苯酚,可用浓溴水来除杂 |
B、1mol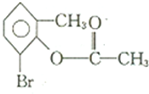 在一定条件下与足量NaOH溶液反应,最多消耗3mol NaOH 在一定条件下与足量NaOH溶液反应,最多消耗3mol NaOH |
C、按系统命名法,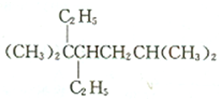 的名称为3,3,6一三甲基-4-乙基庚烷 的名称为3,3,6一三甲基-4-乙基庚烷 |
D、已知C-C键可以绕键轴自由旋转,结构简式为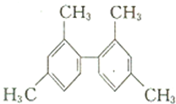 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
| A、对钢材“发蓝”(钝化) |
| B、选用铬铁合金 |
| C、外接电源负极 |
| D、连接锌块 |
2SO2+O2
2SO3是制造硫酸的重要反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
下列有关电化学的说法正确的是( )
| A、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| B、电解精炼铜时阴极发生还原反应 |
| C、用铜作电极电解后的硫酸铜溶液中,加入一定量的氧化铜即可恢复溶液的成分和浓度 |
| D、铜锌原电池工作时外电路电子由锌极流向铜极,内电路电子由铜极流向锌极 |
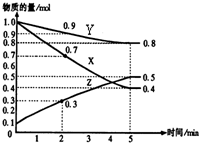 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为: