题目内容
13.下列各组粒子中粒子半径由小到大的是( )| A. | O2- Na+Mg2+Al3+ | B. | O P S Cl | ||
| C. | A l3+Mg2+ Na+ F- | D. | K+ Mg2+ Al3+ H+ |
分析 微粒半径大小一般原则:电子层数不同,电子层数越多,半径越大;
电子层数相同的,质子数越多半径越小;
核外电子数相同的,质子数越多半径越小;据此解答.
解答 解:A.O2- Na+Mg2+Al3+具有相同的核外电子数,微粒半径随着核电荷数增多而减小,所以半径由小到大顺序:Al3+、Mg2+、Na+、O2-,故A错误;
B.O有两个电子层,Cl、S、P,都有三个电子层,质子数越多半径越小,所以0、Cl、S、P依次增大,故B错误;
C.Al3+、Mg2+、Na+、F-都有2个电子层,质子数越小,半径越大,所以半径由小到大顺序:Al3+、Mg2+、Na+、F-,故C正确;
D.钾离子具有3个电子层,Al3+、Mg2+都有2个电子层,且二者质子数逐渐减小,氢离子一个电子层,所以由小到大顺序:H+、Al3+、Mg2+、K+,故D错误;
故选:C.
点评 本题考查微粒半径比较,题目难度中等,为元素周期律中常考查知识点,学习中注意积累相关比较方法,注重元素周期律递变规律的应用.

练习册系列答案
相关题目
3.若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是( )
| A. | M g | B. | $\frac{1}{M}$g | C. | $\frac{6.02×1{0}^{23}}{M}$g | D. | $\frac{M}{{N}_{A}}$g |
1.在下列物质中,分别加入金属钠,不能产生氢气的是( )
| A. | 水 | B. | 甲苯 | C. | 无水乙醇 | D. | 75%的酒精 |
8.将下列溶液置于敞口容器中,溶液质量会出现增重的是( )
| A. | 浓氨水 | B. | 浓盐酸 | C. | 浓H2SO4 | D. | 浓硝酸 |
18.下列反应中,属于吸热反应的是( )
| A. | 锌与硫酸反应制取氢气 | B. | NaOH与HCl的反应 | ||
| C. | 高温煅烧石灰石 | D. | 铝与稀盐酸 |
5.下列有关实验操作及原理正确的是( )
| A. | 用玻璃棒蘸取NaClO溶液,点在干燥的pH试纸上,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 将Cu与浓硫酸反应剩余的液体加入到盛有蒸馏水的烧杯中,以证明反应生成了CuSO4 | |
| D. | 用乙醇、乙酸制取乙酸乙酯的过程中发现忘加碎瓷片,可立即补加 |
3.下列说法错误的是( )
| A. | 非金属两原子间不可能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物 | |
| C. | 含有非极性键的分子,不一定是共价化合物 | |
| D. | 离子化合物中一定不含共价键 |
 .
.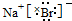 .
.