题目内容
对可逆反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关.现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-Q kJ?mol-1.在850℃时,K=1.
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”).
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 .
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”).
| [c(C)]c?[c(D)]d |
| [c(A)]a?[c(B)]b |
(1)若升高温度到950℃时,达到平衡时K
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:①当x=5.0时,上述平衡向
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)反应是放热反应,升温平衡逆向进行;
(2)①反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
②用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<k,据此计算判断;
(3)增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的.
(2)①反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
②用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<k,据此计算判断;
(3)增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的.
解答:
解:(1)反应是放热反应,升温平衡逆向进行,若升高温度到950℃时,达到平衡时K小于1,故答案为:小于;
(2)①此时的浓度商Qc=
=1.67,大于平衡常数1,故平衡向逆反应方向移动,故答案为:逆反应;
②平衡向正反应方向移动,浓度商小于平衡常数,即
<1,解得x<3.0,故答案为:x<3.0;
(3)加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生成物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,故答案为:小于.
(2)①此时的浓度商Qc=
| 1×5 |
| 1×3 |
②平衡向正反应方向移动,浓度商小于平衡常数,即
| 1×x |
| 1×3 |
(3)加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生成物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,故答案为:小于.
点评:本题考查转化率、化学平衡有关计算、化学平衡移动与影响因素等,注意平衡常数的应用、平衡移动的本质是解答的关键,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
关于下列实验装置的叙述中,正确的是( )
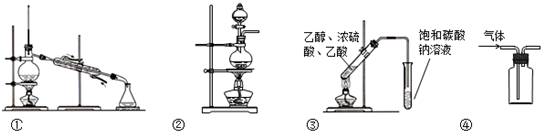

| A、装置①常用于分离互不相溶的液体 |
| B、装置②可用于实验室加热酒精与浓硫酸的混合物制取乙烯 |
| C、装置③可用于制备乙酸乙酯 |
| D、装置④可用于收集NO、CO2等气体 |
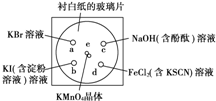 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.