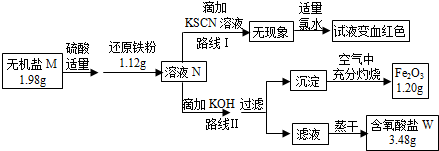
题目内容
2.某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断不正确的是( )| A. | 溶液中共发生了1个氧化还原反应 | |
| B. | 反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ | |
| C. | 有胶状物质生成 | |
| D. | 溶液颜色发生变化 |
分析 溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体.
解答 解:某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体,
A.共发生了氯气氧化SO32-、Br-2个氧化还原反应,氯气和水发生的氧化反应,共3个氧化还原反应,故A错误;
B.反应前后,溶液中离子浓度基本保持不变的有NH4+-、Na+,故B正确;
C.有胶状物质硅酸生成,故C正确;
D.氯气氧化溴离子为溴单质,溶液颜色发生变化有无色变化为橙红色,故D正确;
故选A.
点评 本题考查了氯水成分和离子反应的判断,题目难度中等,明确氯气的化学性质为解答关键,注意掌握常见元素单质及其化合物性质,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.下列离子方程式不正确的是( )
| A. | 向NaClO溶液中滴入少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O | |
| B. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | Na2SO3溶液中SO32-的水解:SO32-+H2O$\frac{\underline{\;电解\;}}{\;}$HSO3-+OH- |
13.从图中表示的各物质能量变化推断下列热化学方程式正确的是(a、b均为正数)( )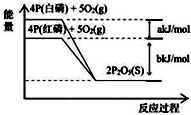

| A. | 4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol | |
| B. | 4P(红磷)+5O2(g)═2P2O5(S);△H2=-(b)kJ/mol | |
| C. | 4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol | |
| D. | P(白磷)═P(红磷);△H4=+(a)kJ/mol |
10.下列关于实验操作的叙述不正确的是( )
| A. | 蒸馏时,在烧瓶中加几粒沸石 | |
| B. | 加液时,胶头滴管悬置在试管正上方 | |
| C. | 萃取时,分液漏斗正立振荡后,直接放在铁架台上,静置 | |
| D. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
14.下列物质不会列人首要污染物的是( )
| A. | 二氧化碳 | B. | 二氧化硫 | C. | 二氧化氮 | D. | 一氧化氮 |
11.下列反应中,既属于氧化还原反应又属于置换反应的是( )
| A. | CuO+H2$\frac{\underline{\;高温\;}}{\;}$Cu+H2O | B. | CO2+Ca(OH)2$\frac{\underline{\;点燃\;}}{\;}$CaCO3↓+H2O | ||
| C. | Fe2O3+3CO═2Fe+3CO2 | D. | 2Na+Cl2═2NaCl |
12.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | 漂白粉溶液中:K+、Na+、I-、CO32- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH- |