题目内容
铁及其化合物在生活、生产中有着广泛的应用.
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂.
某学习小组用下列流程测定铁触媒的含铁量.根据题意回答相关问题:
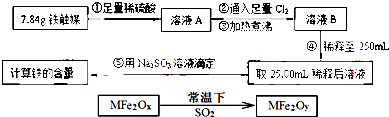
(1)步骤①中需用1.50mol?L-1的硫酸100mL,若用18.4mol?L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液.
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用.
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如图:
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂.
某学习小组用下列流程测定铁触媒的含铁量.根据题意回答相关问题:

(1)步骤①中需用1.50mol?L-1的硫酸100mL,若用18.4mol?L-1的浓硫酸来配制,则需要用量筒量取浓硫酸
(2)步骤②通入Cl2的目的是
(3)步骤④后需用
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如图:
则可以判断x
考点:探究物质的组成或测量物质的含量,复杂化学式的确定
专题:实验探究和数据处理题,计算题
分析:Ⅰ、(1)依据溶液中溶质不变计算得到;
(2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子;
(3)步骤④后的溶液显酸性,依据取用体积为25.00ml,则需用精确量具酸式滴定管取用;
(4)依据铁离子和亚硫酸钠溶液反应的定量关系计算铁元素质量分数;
Ⅱ、(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式;氢氧化铁胶体具有吸附作用;
(2)根据化合价的变化判断反应物在反应中是氧化剂还是还原剂或是催化剂,根据化合价代数和为0判断x与y的关系.
(2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子;
(3)步骤④后的溶液显酸性,依据取用体积为25.00ml,则需用精确量具酸式滴定管取用;
(4)依据铁离子和亚硫酸钠溶液反应的定量关系计算铁元素质量分数;
Ⅱ、(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式;氢氧化铁胶体具有吸附作用;
(2)根据化合价的变化判断反应物在反应中是氧化剂还是还原剂或是催化剂,根据化合价代数和为0判断x与y的关系.
解答:
解:Ⅰ、(1)步骤①中需用1.50mol?L-1的硫酸100mL,若用18.4mol?L-1的浓硫酸来配制,依据溶液稀释过程中溶质物质的量不变列式计算,1.50mol?L-1×0.100L=18.4mol?L-1×V
V=0.0082L=8.2ml,则需要用量筒量取浓硫酸.2ml;
故答案为:8.2;
(2)步骤②通入Cl2的目的是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④后的溶液显酸性,依据取用体积为25.00ml,则需用精确量具酸式滴定管取用;
故答案为:酸式滴定管;
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,
SO32-+2Fe3++H2O=2Fe2++2H++SO42-
1 2
0.10mol/L×0.025L n
n=0.05mol
250ml溶液中铁元素物质的量=0.05mol×
=0.5mol
则铁触媒中铁的质量分数为
×100%=35.7%
故答案为:35.7%;
Ⅱ.(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;氢氧化铁胶体具有吸附作用,能吸附悬浮在水中的杂质净水,发生聚沉;
4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;聚沉;
(2)在图示反应中,SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,氧化剂氧化性大于氧化产物,二氧化硫氧化性大于MFe2Oy;SO2在反应中为氧化剂,参与氧化还原反应,MFe2Ox为还原剂,反应后Fe元素的化合价升高,根据化合价代数和,则有(2y-2)>(2x-2),即y>x,
故答案为:<;<;
V=0.0082L=8.2ml,则需要用量筒量取浓硫酸.2ml;
故答案为:8.2;
(2)步骤②通入Cl2的目的是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④后的溶液显酸性,依据取用体积为25.00ml,则需用精确量具酸式滴定管取用;
故答案为:酸式滴定管;
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,
SO32-+2Fe3++H2O=2Fe2++2H++SO42-
1 2
0.10mol/L×0.025L n
n=0.05mol
250ml溶液中铁元素物质的量=0.05mol×
| 250 |
| 25 |
则铁触媒中铁的质量分数为
| 0.5mol×56g/mol |
| 7.84g |
故答案为:35.7%;
Ⅱ.(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;氢氧化铁胶体具有吸附作用,能吸附悬浮在水中的杂质净水,发生聚沉;
4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;聚沉;
(2)在图示反应中,SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,氧化剂氧化性大于氧化产物,二氧化硫氧化性大于MFe2Oy;SO2在反应中为氧化剂,参与氧化还原反应,MFe2Ox为还原剂,反应后Fe元素的化合价升高,根据化合价代数和,则有(2y-2)>(2x-2),即y>x,
故答案为:<;<;
点评:本题考查了物质性质的分析,物质组成的实验探究方法和实验过程分析判断,氧化还原反应实质理解和化学式变化的计算应用,掌握基础是关键,题目难度较大.

练习册系列答案
相关题目
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
根据如图转化关系推测下列说法中不正确的是( )

根据如图转化关系推测下列说法中不正确的是( )

| A、可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘 |
| B、在碘水中通入Cl2,发生反应的化学方程式为5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为:Cl2>I2>IO3- |
| D、途径Ⅲ中若消耗1 mol Cl2,反应中转移的电子数为2NA |
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )


| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、实验仪器D可以起到防止溶液倒吸的作用 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中变浑浊 |
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类100年的能源需求.天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子. 若晶体中每8个笼中有6个笼容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
| A、CH4?14H2O |
| B、CH4?8H2O |
| C、CH4?7H2O |
| D、CH4?6H2O |



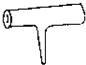 实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.