题目内容
7.设NA为阿伏伽德罗常数值.下列有关叙述不正确的是( )| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA |
分析 A.质量转化为物质的量,结合1个2CaSO4•H2O含有2个水分子;
B.该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K37ClO3、还原剂 H35Cl,该反应转移的电子数为5e-.;
C.乙酸与葡萄糖最简式都是CH2O;
D.1个CnH2n-2含有2n-2个C-H键,n-1个C-C键.
解答 解:A.熟石膏(2CaSO4•H2O)的物质的量n=$\frac{m}{M}$=$\frac{5.8g}{290g/mol}$=0.02mol,由熟石膏(2CaSO4•H2O)的化学式可知,1mol熟石膏(2CaSO4•H2O)中含1mol水,故0.02mol水中含0.02mol水,即0.02NA个,故A正确;
B.生成的3mol氯气中含6molCl,其中1mol为 37Cl,5mol为35Cl,生成氯气摩尔质量=$\frac{1×37+5×35}{70.7}$=70.7g/mol,若有212克氯气生成物质的量=$\frac{212g}{70.7g/mol}$=3mol,生成3mol氯气电子转移5mol,故B正确;
C.乙酸与葡萄糖最简式都是CH2O,1个CH2O完全燃烧消耗1个氧气分子,60克的乙酸和葡萄糖混合物含有CH2O物质量为2mol,充分燃烧消耗2NA个O2,故C正确;
D.1个CnH2n-2含有2n-2个C-H键,n-1个C-C键,共有3n-3个共用电子对,所以1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n-3)NA,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用与计算,明确相关物质的结构组成,熟悉以物质的量为核心计算公式是解题关键,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
18.下列关于吸热反应的分析正确的是( )
| A. | 生成物化学键形成时也会吸收热量 | |
| B. | 生成物的总能量高于反应物的总能量 | |
| C. | 一定需要加热条件下才能实现 | |
| D. | 使用催化剂可以降低吸热反应的热效应 |
15.在其它条件不变时,10℃时以某物质表示的反应速率为3mol•(L•s )-1,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为( )
| A. | 48 mol•(L•s )-1 | B. | 36 mol•(L•s )-1 | C. | 24 mol•(L•s )-1 | D. | 12 mol•(L•s )-1 |
2.关于溶液的下列说法正确的是( )
| A. | 等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| B. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| C. | 往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
12.如图所示的装置中,属于原电池的是( )


| A. | A | B. | B | C. | C | D. | D |
19.表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑦元素以原子个数1:2组成分子的电子式: ;
;
用电子式表示③与④两种元素对应化合物的形成过程: .
.
(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式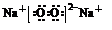 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
 ;
;用电子式表示③与④两种元素对应化合物的形成过程:
 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
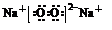 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
16.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 92g乙醇与足量的金属钠反应,生成氢气(H2)的分子数为NA | |
| C. | 标准状况下,22.4L已烷中碳碳键数目为5NA | |
| D. | 乙烯和甲醚的混合物共0.1mol,完全燃烧所消耗的氧分子数一定为0.6NA |
8.下列物质既能与盐酸反应又能与NaOH溶液反应,并且都放出氢气的是( )
| A. | Fe | B. | Al | C. | Al2O3 | D. | Si |