题目内容
13.恒温恒容下,将4molA和2molB通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)?xC(g)+2D(s),2min后反应达到平衡状态,此时剩余0.8molB,并测得C的浓度为1.8mol/L.(1)X=3
(2)从开始反应至平衡状态,生成C的平均反应速率为0.9mol/(L•min)
(3)气体A的转化率为60%.
分析 2min后反应达到平衡状态,此时剩余0.8molB,则消耗B的物质的量为2mol-0.8mol=1.2mol,测得C的浓度为1.8mol/L,则生成C的物质的量为1.8mol/L×2L=3.6mol,则
2A(g)+B(g)?xC(g)+2D(s)
起始(mol) 4 2 0
转化(mol) 2.4 1.2 1.2x
平衡(mol) 1.6 0.8 3.6
则有1.2x=3.6,以此解答该题.
解答 解:(1)由以上分析可知1.2x=3.6,x=3,故答案为:3;
(2)从开始反应至平衡状态,生成C的平均反应速率为$\frac{\frac{3.6mol}{2L}}{2min}$=0.9mol/(L•min),故答案为:0.9mol/(L•min);
(3)气体A的转化率为$\frac{2.4}{4}×100%$=60%,故答案为:60%.
点评 本题考查化学平衡的计算,为高频考点和常见题型,题目难度中等,注意利用物质的量的关系确定x为解答的关键,注重高考常考考点的考查,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3(正反应是放热反应).下列有关说法正确的是( )
| A. | 升高温度能加快反应速率 | |
| B. | 1mol N2和3mol H2的总能量低于2mol NH3的总能量 | |
| C. | 达到化学反应限度时,生成2molNH3 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
15.下列关于有机化合物的认识正确的是( )
①在铁粉存在下,苯与液溴的反应属于取代反应
②氯乙烷与NaOH水溶液共热可生成乙烯
③甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
④苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
⑤用酸性高锰酸钾溶液可区分己烷和3-己烯
⑥用水可区分苯和溴苯.
①在铁粉存在下,苯与液溴的反应属于取代反应
②氯乙烷与NaOH水溶液共热可生成乙烯
③甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
④苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
⑤用酸性高锰酸钾溶液可区分己烷和3-己烯
⑥用水可区分苯和溴苯.
| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ②③④⑤⑥ |
1.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
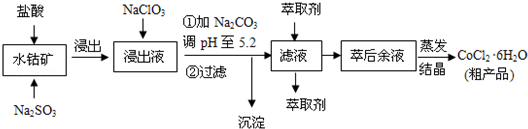
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
18. 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl2-$?_{放电}^{充电}$2VCl3+Br-.
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl2-$?_{放电}^{充电}$2VCl3+Br-.
下列说法不正确的是( )
 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl2-$?_{放电}^{充电}$2VCl3+Br-.
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl2-$?_{放电}^{充电}$2VCl3+Br-.下列说法不正确的是( )
| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的负极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-=BrCl2- |
2.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | 乙烯的结构简式 CH2CH2 | ||
| C. | CO2的结构式 O=O=C | D. | 苯分子的比例模型 |
3. 一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )
一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )
 一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )
一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )| A. | 该反应是一个可逆反应 | B. | 反应后体系内压强增大 | ||
| C. | Y、Z的化学式分别是N2O、N2O3 | D. | Y、Z的化学式分别是N2O、NO2 |