题目内容
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)①②⑤中,最高价氧化物对应的水化物碱性最强的是 .
(2)②③④中形成的简单离子半径由大到小的顺序是 .
(3)元素⑦的氢化物电子式为 ,该氢化物常温下和元素②的单质反应的离子方程式是
(4)①和⑨的最高价氧化物对应的水化物的化学式为 和 .①和⑨两元素形成化合物的化学式为 ,该化合物灼烧时焰色为 ,该化合物的溶液与元素⑧的单质反应的离子方程式为 .
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为 .
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)②③④中形成的简单离子半径由大到小的顺序是
(3)元素⑦的氢化物电子式为
(4)①和⑨的最高价氧化物对应的水化物的化学式为
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,
(1)金属性越强,最高价氧化物对应的水化物碱性越强;
(2)核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小;
(3)元素⑦的氢化物为水,可与钾发生反应生成氢氧化钾和氢气;
(4)①和⑨的最高价氧化物对应的水化物分别为氢氧化钠和高溴酸;①和⑨两元素形成化合物为NaBr,溶液可与氯气反应;
(5)①和⑤最高价氧化物对应的水化物的反应为氢氧化钠和氢氧化铝的反应.
(1)金属性越强,最高价氧化物对应的水化物碱性越强;
(2)核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小;
(3)元素⑦的氢化物为水,可与钾发生反应生成氢氧化钾和氢气;
(4)①和⑨的最高价氧化物对应的水化物分别为氢氧化钠和高溴酸;①和⑨两元素形成化合物为NaBr,溶液可与氯气反应;
(5)①和⑤最高价氧化物对应的水化物的反应为氢氧化钠和氢氧化铝的反应.
解答:
解:由元素在周期表中位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,
(1)①②⑤的最高价氧化物对应水化物分别是KOH、NaOH、Al(OH)3,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,根据金属性的递变规律可知,金属性:K>Na>Al,则碱性KOH>NaOH>Al(OH)3,
故答案为:KOH;
(2))②③④中形成的简单离子分别为K+、Ca2+、Mg2+,由同周期金属离子半径从左到右逐渐减小,同主族离子半径从上到下逐渐增大可知,离子半径K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(3)元素⑦的氢化物为水,电子式为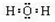 ,可与钾发生反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+H2↑,
,可与钾发生反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+H2↑,
故答案为: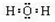 ; 2K+2H2O═2K++2OH-+H2↑;
; 2K+2H2O═2K++2OH-+H2↑;
(4)①和⑨的最高价氧化物对应的水化物分别为NaOH和HBrO4;①和⑨两元素形成化合物为NaBr,含有钠元素,焰色反应呈黄色,溶液可与氯气反应,反应的离子方程式为Cl2+2Br-═2Cl-+Br2,
故答案为:NaOH;HBrO4;NaBr;黄色;Cl2+2Br-═2Cl-+Br2;
(5)①和⑤最高价氧化物对应的水化物的反应为氢氧化钠和氢氧化铝的反应,化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3═NaAlO2+2H2O.
(1)①②⑤的最高价氧化物对应水化物分别是KOH、NaOH、Al(OH)3,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,根据金属性的递变规律可知,金属性:K>Na>Al,则碱性KOH>NaOH>Al(OH)3,
故答案为:KOH;
(2))②③④中形成的简单离子分别为K+、Ca2+、Mg2+,由同周期金属离子半径从左到右逐渐减小,同主族离子半径从上到下逐渐增大可知,离子半径K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(3)元素⑦的氢化物为水,电子式为
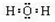 ,可与钾发生反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+H2↑,
,可与钾发生反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为:
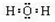 ; 2K+2H2O═2K++2OH-+H2↑;
; 2K+2H2O═2K++2OH-+H2↑;(4)①和⑨的最高价氧化物对应的水化物分别为NaOH和HBrO4;①和⑨两元素形成化合物为NaBr,含有钠元素,焰色反应呈黄色,溶液可与氯气反应,反应的离子方程式为Cl2+2Br-═2Cl-+Br2,
故答案为:NaOH;HBrO4;NaBr;黄色;Cl2+2Br-═2Cl-+Br2;
(5)①和⑤最高价氧化物对应的水化物的反应为氢氧化钠和氢氧化铝的反应,化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3═NaAlO2+2H2O.
点评:本题考查位置结构性质的关系及应用,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意根据元素所在周期表中的位置结合元素周期律知识解答.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
下列有关化学用语表示正确的是( )
A、NH4Br的电子式: | ||
B、S原子的结构示意图: | ||
| C、乙醇的结构简式:C2H6O | ||
D、原子核内有18个中子的氯原子:
|
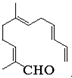 从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( ) ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 如图所示装置组成一种原电池.试回答下列问题:
如图所示装置组成一种原电池.试回答下列问题: 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.CO(g)的燃烧热△H为-283.0kJ?mol-1,已知1mol甲醇(CH3OH)完全燃烧放出热量为726.5kJ.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.CO(g)的燃烧热△H为-283.0kJ?mol-1,已知1mol甲醇(CH3OH)完全燃烧放出热量为726.5kJ.请回答下列问题: A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.

 和
和 ,鉴别I和J的试剂为
,鉴别I和J的试剂为
