题目内容
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4.将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol?L-1.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算
2SO2(g)+O2(g)?2SO3(g)
起始(mol/L):0.050 0.030 0
转化(mol/L):0.040 0.020 0.040
平衡(mol/L):0.010 0.010 0.040
计算出平衡时各物质的浓度,可计算平衡常数和转化率.
2SO2(g)+O2(g)?2SO3(g)
起始(mol/L):0.050 0.030 0
转化(mol/L):0.040 0.020 0.040
平衡(mol/L):0.010 0.010 0.040
计算出平衡时各物质的浓度,可计算平衡常数和转化率.
解答:
解:依据化学平衡三段式列式计算
2SO2(g)+O2(g)?2SO3(g)
起始(mol/L):0.050 0.030 0
转化(mol/L):0.040 0.020 0.040
平衡(mol/L):0.010 0.010 0.040
K=
=
=1600,
α(SO2)=
×100%=80%,
答:该条件下反应的平衡常数K为1600,SO2的平衡转化率为80%.
2SO2(g)+O2(g)?2SO3(g)
起始(mol/L):0.050 0.030 0
转化(mol/L):0.040 0.020 0.040
平衡(mol/L):0.010 0.010 0.040
K=
| c2(SO3) |
| c2(SO2)c(O2) |
| 0.0402 |
| 0.0102×0.010 |
α(SO2)=
| 0.040mol/L |
| 0.050mol/L |
答:该条件下反应的平衡常数K为1600,SO2的平衡转化率为80%.
点评:本题考查了化学平衡常数、平衡转化率应用等考点,题目难度中等,注意平衡常数在计算中的应用.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核最外层电子数之和等于Y、Z元素的原子序数之和.下列说法不正确的是( )
| X | Y | ||
| Z | W |
| A、X、W的最高价氧化物对应的水化物均是强酸 |
| B、X、Z均可与Y形成原子个数之比1:2的化合物 |
| C、四种元素之间不可能形成离子型化合物 |
| D、Z的最高价氧化物能溶于X的最高价氧化物对应的水化物中 |
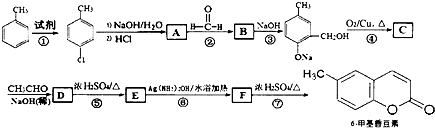
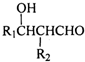 ,其中R1和R2为(烃基或H).请回答下列问题:
,其中R1和R2为(烃基或H).请回答下列问题: 结构且苯环上有2种化学环境的氢原子
结构且苯环上有2种化学环境的氢原子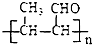 )请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO
)请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下: