题目内容
13.14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况)O2混合,通入水中全部被吸收.求合金中铜的质量.分析 铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答 解:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g,
根据电子守恒列方程:2x+1×y=0.05mol×4,
解得:x=0.05mol,y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
答:合金中铜的质量为3.2g.
点评 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
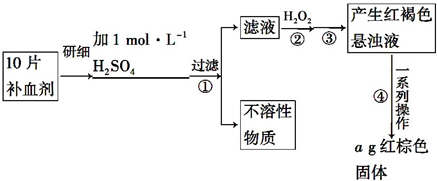
3.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
(1)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除尽;
②将浊液加热到 80℃,趁热过滤
(2)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,
(3)当离子浓度小于或等于1×10-5 mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
①加入石灰乳调节pH到约3.2,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除尽;
②将浊液加热到 80℃,趁热过滤
(2)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,
(3)当离子浓度小于或等于1×10-5 mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
8.下列叙述正确的是( )
| A. | 等质量的H2S和PH3含有相同的原子数 | |
| B. | NH3的摩尔质量为17 | |
| C. | 9.03×1023个CO2分子的质量为66g | |
| D. | 同温同压下,相同体积的物质,其物质的量一定相等 |
5.在FeCl3与CuCl2的混合溶液中加入一定量的铁粉,反应完毕后,有固体剩余,下列说法正确的是( )
| A. | 烧杯中一定有铜,可能有铁 | |
| B. | 烧杯中铁铜都有 | |
| C. | 溶液中一定有Fe2+,可能有Cu2+、Fe3+ | |
| D. | 烧杯中有铁无铜 |
2.下列叙述中不正确的是( )
| A. | P4和NO2都是共价化合物 | B. | 在SiO2晶体中,不存在单个小分子 | ||
| C. | CCl4是以极性键结合的非极性分子 | D. | 二氯甲烷不存在同分异构体 |
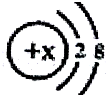 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.