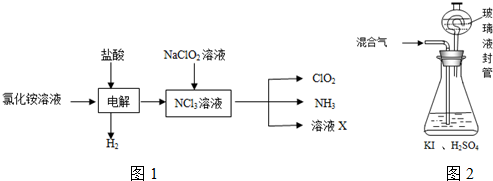
题目内容
3.氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂.以粗盐水(含Ca2+、Mg2+、SO42-等杂质).Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下: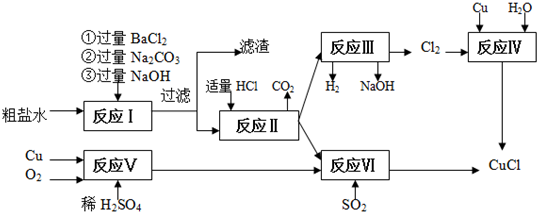
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是除去Ca2+和过量的Ba2+.
滤渣的主要成分:BaSO4、CaCO3、Mg(OH)2、BaCO3.
(2)反应Ⅱ完成后溶液中主要溶质是NaCl.
(3)反应Ⅴ的化学方程式为2Cu+O2+4H2SO4=2CuSO4+2H2O.
(4)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是防止生成CuCl2.
②写出反应VI的离子方程式2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-.
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化.
分析 由流程分析,粗盐水加入过量氯化钡沉淀硫酸根离子,加入过量氢氧化钠沉淀镁离子,最后加入碳酸钠沉淀过量的钡离子、钙离子,过滤后加入盐酸除去过量的碳酸钠,得到较纯净的氯化钠溶液,电解得到氢氧化钠溶液,氢气和氯气,利用生成的氯气和过量铜反应生成氯化亚铜;也可以利用铜、氧气、稀硫酸反应生成硫酸铜通入二氧化硫还原得到氯化亚铜,
(1)碳酸根离子可以和钡离子以及钙离子之间发生反应生成碳酸钙以及碳酸钡沉淀,据此分析滤渣成分即可;
(2)依据反应判断剩余溶质;
(3)在硫酸溶液中铜与氧气反应生成硫酸铜和水;
(4)①金属铜可以和铜离子在溶液中生成亚铜离子;
②二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀;
(5)乙醇和水易挥发,CuCl具有还原性,可以被空气氧化;
解答 解:由流程分析,粗盐水加入过量氯化钡沉淀硫酸根离子,加入过量氢氧化钠沉淀镁离子,最后加入碳酸钠沉淀过量的钡离子、钙离子,过滤后加入盐酸除去过量的碳酸钠,得到较纯净的氯化钠溶液,电解得到氢氧化钠溶液,氢气和氯气,利用生成的氯气和过量铜反应生成氯化亚铜;也可以利用铜、氧气、稀硫酸反应生成硫酸铜通入二氧化硫还原得到氯化亚铜,
(1)反应Ⅰ中加Na2CO3溶液可以粗盐溶液中的除去Ca2+和除去硫酸根离子所加的过量的Ba2+,生成的沉淀为:氢氧化镁、硫酸钡、碳酸钡、碳酸钙,
故答案为:除去Ca2+和过量的Ba2+;BaSO4、CaCO3、Mg(OH)2、BaCO3;
(2)依据(1)的分析可知,最后溶液中的溶质为氯化钠,
故答案为:NaCl;
(3)在硫酸溶液中铜与氧气反应生成硫酸铜和水,反应的方程式为2Cu+O2+4H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+4H2SO4=2CuSO4+2H2O;
(4)①反应Ⅳ加入的Cu必须过量,金属铜可以和铜离子在溶液中生成亚铜离子,这样可以防止生成CuCl2,
故答案为:防止生成CuCl2;
②二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,即2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4,
故答案为:2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-;
(5)CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.
点评 本题涉及物质的分离和提纯的方法以及操作、电解池的工作原理等方面的知识,注意知识的迁移和应用是解题的关键,难度不大.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,它的熔点一般比纯钛要低 |
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.下列说法不正确的是( )
| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
 (该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为
(该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为 ).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )
).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )| A. | CH2=CH2和N2 | B. | CH3-C≡C-NH2 | C. | HC≡C-C≡N | D. | CH2=CH-CH=NH |
 用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:
用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求: