题目内容
20.A、B、D、E、G是原子序数依次增大的五种短周期元素.A与E同主族,B与G同主族,A、B和E的原子最外层电子数之和为19,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,D为同周期主族元素中原子半径最大的元素.(1)B在元素周期表中的位置是第2周期第VIIA族.
(2)D的两种常见氧化物中均含有离子键(填“离子键”或“共价键”)
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)常温下,D的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H2O.
(5)共价键的极性随共用电子对偏移程度的增大而增强,A和E所形成氢化物中,共价键极性强的为H2O(用化学式表示).
分析 B与G同主族,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B为F元素,G为Cl元素,D为同周期主族元素中原子半径最大的元素,且原子序数大于F,小于Cl,应为Na元素,A与E同主族,A、B和E的原子最外层电子数之和为19,可知A与E的最外层电子数都为6,则A为O元素,E为S元素,结合对应单质、化合物的性质以及元素周期率知识的解答该题.
解答 解:B与G同主族,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B为F元素,G为Cl元素,D为同周期主族元素中原子半径最大的元素,且原子序数大于F,小于Cl,应为Na元素,A与E同主族,A、B和E的原子最外层电子数之和为19,可知A与E的最外层电子数都为6,则A为O元素,E为S元素,
(1)B为F元素,位于周期表第2周期 第VIIA族,故答案为:第2周期 第VIIA族;
(2)D为Na元素,为活泼金属,对应的氧化物为离子化合物,含有离子键,故答案为:离子键;
(3)E的最高价氧化物对应水化物的浓溶液为浓硫酸,具有强氧化性,和木炭共热,反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;
(4)氯气和氢氧化钠反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H2O,
故答案为:Cl2+2OH-═ClO-+Cl-+H2O;
(5)A和E所形成氢化物分别为水和硫化氢,O的非金属性较强,分子极性较强,故答案为:H2O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

仅依据下表给出的物理量X和Y,其中不能求出物质的量的是
A | B | C | D | |
X | 物质中的粒子数 | 标准状况下的 气体摩尔体积 | 固体的体积 | 溶液中溶质的 物质的量浓度 |
Y | 阿伏加德罗常数 | 标准状况下 气体的体积 | 固体的密度 | 溶液体积 |
| 物质(杂质) | 试剂 | 方法 | |
| A | Cl2(HCl) | 饱和食盐水,浓硫酸 | 洗气 |
| B | 溴化钠(溴) | CCl4、水 | 萃取、分液 |
| C | 乙醇(乙酸) | NaOH溶液 | 分液 |
| D | 溴苯(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
①钠的化合物; ②能与硝酸反应的物质; ③可溶于水的物质;
④电解质; ⑤钠盐; ⑥钠的含氧化合物.
| A. | ①③④ | B. | ①②⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
| A. | HCOOCH3、CH3COOH | B. | 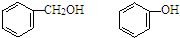 | ||
| C. | C15H31COOH、C17H35COOH | D. | 乙醇、丙三醇 |
| A. | 镁 | B. | 铁 | C. | 铜 | D. | 银 |
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 硝酸具有强氧化性--铜单质易溶于浓硝酸 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 二氧化硫具有还原性--二氧化硫能使高锰酸钾溶液褪色 |
| A. |  过滤 | B. |  渗析 渗析 | C. |  萃取 | D. |  丁达尔效应 |
 的
的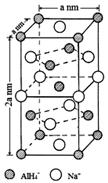 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键).