题目内容
2.可逆反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下反应速率分别如下,其中反应速率最大的是( )| A. | v(A)=0.25mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.3mol/(L•min) | D. | v(D)=0.1mol/(L•min) |
分析 反应速率的单位相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.
解答 解:A、$\frac{{V}_{(A})}{1}$=0.25mol/(L•min),
B、v(B)×$\frac{1}{3}$=0.2mol/(L•min),
C、v(C)×$\frac{1}{2}$=0.15mol/(L•min),
D、v(D)×$\frac{1}{2}$=0.05mol/(L•min),
所以反应速率v(A)>v(B)>v(C)>v(D).
故选A.
点评 本题考查了比较反应速率的方法,常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.比较反应速率时注意(1)反应速率的单位要相同(2)单位时间内反应物或生成物的物质的量变化大,反应速率不一定快,反应速率是用单位时间内浓度的变化量来表示的,题目较简单.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
12.下列说法正确的是( )
| A. | 卤素元素最外层电子数都是7个,单质化学性质均较稳定 | |
| B. | 卤素元素的单质从上到下熔、沸点依次升高 | |
| C. | 卤素元素的单质从上到下颜色逐渐变浅 | |
| D. | 卤素元素从上到下随电子层数的增多非金属性也依次增强 |
13.下列说法正确的是( )
| A. | 不粘锅的原料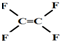 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 油脂在酸性或碱性条件下都能发生水解反应制取肥皂 |
10.如果n为第ⅡA族中某元素原子序数,则原子序数为(n+1)的元素位于( )
①ⅢA ②ⅣA ③ⅢB ④ⅠA.
①ⅢA ②ⅣA ③ⅢB ④ⅠA.
| A. | ①③ | B. | ①② | C. | ②③ | D. | ①③④ |
17.如表为元素周期表的一部分用元素符号或化学式回答下列问题
(1)写出⑥与⑧元素组成的分子的电子式: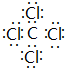 .
.
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2 Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式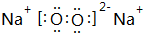 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
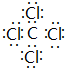 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2 Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
7.常温下向蒸馏水中加入冰醋酸晶体,恢复至室温,测得溶液的pH为2.下列对该溶液的叙述中不正确的是( )
| A. | 醋酸溶液的浓度为0.01mol/L | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol/L | |
| C. | 冰醋酸晶体的加入抑制了水的电离 | |
| D. | 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
12.A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
(1)元素Y是C下一周期同主族元素,比较B、Y元素第一电离能的大小I1(B)>I1(Y).
(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2.
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性强(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键.
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E的单质是日常生活中用量最大的金属材料 |
(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2.
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性强(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键.
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+. 
 和CH3CH2CH2CH2CH3.
和CH3CH2CH2CH2CH3.