题目内容
3. 减少污染、保护环境是全世界最热门的课题.请回答下列问题:
减少污染、保护环境是全世界最热门的课题.请回答下列问题:(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g);△H=+13l.3kJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3、
(2)污染物CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).
①在恒容体系中,可以判断反应达到平衡状态的依据是AC填序号).
a. v正(CH3OH)=v逆(CO) b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. c(CO):c(H2):c( CH3OH)=1:2:1
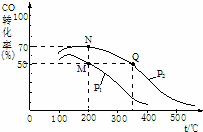
②在密闭容器中充有10molCO与20molH2,CO的平衡转化率与温度、压强的关系如图,M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ.
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②若加入1mol空气(含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算5s内该反应的平均速率ν(NO)和该温度下的平衡常数K(写出计算过程,计算过程中数据可作近似处理)
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)△H>0,该设想能否实现?否(选填“能”或“不能”),依据是该反应是焓增,熵减的反应,根据△H-T•△S>0,任何温度下均不能自发进行.
④目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
分析 (1)①已知:a、H2 (g)+$\frac{1}{2}$O2 (g)=H2O(g);△H=-241.8 kJ/mol,
b、C (s)+$\frac{1}{2}$O2 (g)=CO (g);△H=-110.5kJ/mol,利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)利用盖斯定律计算反应热;
②根据酸性氧化物的性质选择;
(2)①可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
(3)①依据化学反应速率和平衡移动原理分析判断;
②计算出平衡时各种物质的物质的量,结合平衡常数的表达式以及v=$\frac{△n}{△t}$来计算;
③依据反应自发进行的条件是△H-T△S<0分析判断;
④根据CO和NO反应生成物为氮气和二氧化碳书写.
解答 解:(1)①已知:a、H2 (g)+$\frac{1}{2}$O2 (g)=H2O(g);△H=-241.8 kJ/mol,
b、C (s)+$\frac{1}{2}$O2 (g)=CO (g);△H=-110.5kJ/mol,
利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g);△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g);△H=+13l.3 kJ/mol;
②洗涤含SO2的烟气,SO2是酸性氧化物,应选a.Ca(OH)2,b.Na2CO3,故答案为:ab;
(2)①.v正(CH3OH)=v逆(CO)说明正逆反应速率相等,能作为判断平衡状态的依据,故正确;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,c(CO):c(H2):c( CH3OH)=1:2:1不能说明这一点,所以不能作为判断平衡状态的依据,故错误;
故选AC;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,
故答案为:KM=KN>KQ.
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:温度升高,反应速率加快,平衡右移;
②已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=$\frac{{c}^{2}(NO)}{c({N}_{2})•c({O}_{2})}$=$\frac{8×1{0}^{-4}}{0.8-4×1{0}^{-4}(0.2-4×1{0}^{-4})}$=4×10-6,5s内该反应的平均速率ν(NO)=$\frac{8×1{0}^{-4}}{5}$mol/s=1.6×10-4mol/s,答:5s内该反应的平均速率ν(NO)和该温度下的平衡常数分别是1.6×10-4mol/s、4×10-6;
③2CO(g)=2C(s)+O2(g)已知该反应的△H>0,反应是焓变增大,熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;
故答案为:否;该反应是焓增,熵减的反应,根据△H-T•△S>0,任何温度下均不能自发进行;
④汽车尾气系统装置中CO和NO反应生成物为氮气和二氧化碳,反应的化学方程式为2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
点评 本题考查较为综合,涉及盖斯定律应用、影响平衡移动的因素、汽车尾气的处理等知识,是高考的热点题型,解题时利用盖斯定律求反应热注意方程式变形时,△H的符号和数值,注意影响化学平衡状态的判断是高频考点,题目难度中等.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| A. | CH2═CH-CN | B. | CH2═CH-CH═CH2 | C. |  -CH═CH2 -CH═CH2 | D. | 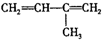 |
| A. | 30g丙醇中存在的共价键总数为5NA | |
| B. | 密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA | |
| C. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA | |
| D. | 2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
| A. | 二氧化硫常用来漂白纸浆 | B. | 漂粉精可用于游泳池的消毒 | ||
| C. | 明矾常用于水质消毒 | D. | 氧化铁常用作红色油漆和涂料 |
| A. | 在中毒过程中血红蛋白被氧化 | B. | 解毒时血红蛋白被还原 | ||
| C. | 维生素C应具有还原性 | D. | 中毒时亚硝酸盐发生氧化反应 |
| A. | 蔗糖 | B. | 熔融的氯化钠 | C. | 氯化氢气体 | D. | 锌片 |
| A. | 对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 | |
| B. | 对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 | |
| C. | 阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH- 浓度增大,溶液显碱性,从而使酚酞变红 | |
| D. | 阴极上的电极反应式为:Cu2++2e-=Cu |
 .
.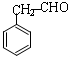 .
.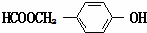 (写结构简式).
(写结构简式). 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: