题目内容
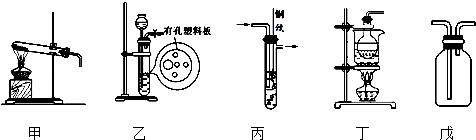
 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
①0.20mol?L-1 ②0.12mol?L-1 ③0.10mol?L-1 ④0.08mol?L-1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在如图中画出第5分钟末达到此平衡时NH3浓度的变化曲线.
考点:化学平衡的计算
专题:
分析:(1)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(2)第5分钟末将容器的体积缩小一半后,氨气的浓度为原来的一倍,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L,以此解答.
(2)第5分钟末将容器的体积缩小一半后,氨气的浓度为原来的一倍,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L,以此解答.
解答:
解:(1)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:①③;
(2)第5分钟末将容器的体积缩小一半后,氨气的浓度为原来的一倍,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L, ,故答案为:
,故答案为: .
.
(2)第5分钟末将容器的体积缩小一半后,氨气的浓度为原来的一倍,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L,
 ,故答案为:
,故答案为: .
.
点评:本题考查化学平衡移动问题,涉及平衡常数、反应速率、平衡标志以及平衡图象等问题,题目难度中等,注意方法性问题的积累.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
在恒温时,一固定容积的容器内发生反应:PCl5(g)?PCl3 (g)+Cl2(g).达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
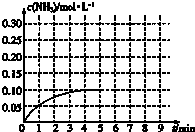
如图表示在催化剂作用下将X和Y合成具有生物活性物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )

| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
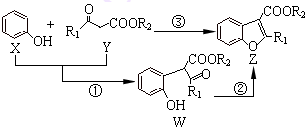
 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为:下列说法不正确的是( )
T1温度下的部分实验数据为:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )


| A、30min时降低温度,40min时充入生成物C |
| B、0~8min内A的平均反应速率为0.08mol/(L?min) |
| C、反应方程式中的x=1,正反应为吸热反应 |
| D、20min~40min间该反应的平衡常数均为8 |
下列分离、提纯、鉴别物质的方法正确的是( )
| A、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| B、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| C、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
| D、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
aXm+、bYn+、cZm-、dQn-(m>n)的电子层结构相同,下列说法正确的是( )
| A、原子半径的大小顺序为:X>Y>Z>Q |
| B、离子半径的大小顺序为:Xm+>Yn+>Zm->Qn- |
| C、m+a=d-n |
| D、b-n=c+m |