题目内容
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g)+2B (g)?C(g)
反应过程中测定的部分数据见下表:
下列说法正确的是( )
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A、前10 min内反应的平均速率为v(C)=0.050 mol?L-1?min-1 |
| B、保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol |
| C、温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
| D、其他条件不变,向平衡体系中再充入0.50molA,与原平衡相比,达到新平衡时,B的转化率增大,A的体积分数增大 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、根据v=
计算A的速率,再利用速率之比等于计量数之比求得C的速率,据此判断;
B、利用等效平衡的思想以及压强对平衡的影响作判断;
C、根据温度对平衡常数的影响作判断;
D、在可逆反应中增加一种反应物的浓度可以提高另一种反应的转化率,而自身的转化率下降,体积分数增大,据此判断.
| △c |
| t |
B、利用等效平衡的思想以及压强对平衡的影响作判断;
C、根据温度对平衡常数的影响作判断;
D、在可逆反应中增加一种反应物的浓度可以提高另一种反应的转化率,而自身的转化率下降,体积分数增大,据此判断.
解答:
解:A、根据v=
计算A的速率为
mol?L-1?min-1=0.025mol?L-1?min-1,由于A和C的计量数之比为1:1,所以C的速率为0.025mol?L-1?min-1,故A错误;
B、起始时向容器中加入0.50 mol A气体和0.60 mol B气体,恰好为原来的起始量的一半,如果平衡不发生移动,则n(C)=0.25 mol,由于体积不变,所以压强比原起始情况的小,该反应是体积减小的反应,减压平衡逆向移动,所以此时到达平衡n(C)<0.25 mol,故B正确;
C、T1℃时,根据表中的数据结合方程式可知,在10min和30min时物质浓度相同,即反应在10min时就处于平衡状态,此时A为0.5mol,B为0.2mol,C为0.5mol,所以此时平衡常数K=
=100,而T2℃时平衡常数为20,且T1>T2,所以降低温度,平衡逆向移动,所以该反应的正反应为吸热反应,故C错误;
D、在可逆反应中增加一种反应物的浓度可以提高另一种反应的转化率,而自身的转化率下降,体积分数增大,由于A、B都是反应物,增加A,B的转化率增大,A的体积分数增大,故D正确;
故选BD.
| △c |
| t |
| ||
| 10 |
B、起始时向容器中加入0.50 mol A气体和0.60 mol B气体,恰好为原来的起始量的一半,如果平衡不发生移动,则n(C)=0.25 mol,由于体积不变,所以压强比原起始情况的小,该反应是体积减小的反应,减压平衡逆向移动,所以此时到达平衡n(C)<0.25 mol,故B正确;
C、T1℃时,根据表中的数据结合方程式可知,在10min和30min时物质浓度相同,即反应在10min时就处于平衡状态,此时A为0.5mol,B为0.2mol,C为0.5mol,所以此时平衡常数K=
| ||||
|
D、在可逆反应中增加一种反应物的浓度可以提高另一种反应的转化率,而自身的转化率下降,体积分数增大,由于A、B都是反应物,增加A,B的转化率增大,A的体积分数增大,故D正确;
故选BD.
点评:本题主要考查了反应速率的计算、等效平衡思想的应用、平衡常数的应用等知识点,中等难度,解题时注意基础知识的运用.

练习册系列答案
相关题目
在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻.甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A、原子半径:丙>乙>甲>丁 |
| B、乙和甲或乙和丁所能形成的化合物都是大气污染物 |
| C、气态氢化物的稳定性:甲>丙 |
| D、最高价氧化物对应水化物的酸性:丁>甲 |
Se是人体必需微量元素,下列关于
Se和
Se说法正确的是( )
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
向0.1mol?L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A、H+数目增加 |
| B、CH3COOH的电离程度变大 |
| C、溶液中c(OH-)增大 |
| D、溶液的导电能力减弱 |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将9.48g KMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到标准状况下0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,则消耗盐酸的物质的量是( )
| A、0.46mol |
| B、0.4mol |
| C、0.28mol |
| D、无法确定 |
物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
| A、3.2 g |
| B、4.0 g |
| C、4.2 g |
| D、4.6 g |
下面有机物的同系物中,完全燃烧产生的水和二氧化碳的物质的量之比恒定的:( )
(a)饱和一元醇,
(b)饱和一元醛,
(c)饱和一元羧酸,
(d)饱和一元醇和饱和一元羧酸生成的酯,
(e)乙炔的同系物,
(f)苯的同系物.
(a)饱和一元醇,
(b)饱和一元醛,
(c)饱和一元羧酸,
(d)饱和一元醇和饱和一元羧酸生成的酯,
(e)乙炔的同系物,
(f)苯的同系物.
| A、(b)(c) |
| B、(a)(d) |
| C、(b)(c)(d) |
| D、(b)(c)(d)(e)(f) |
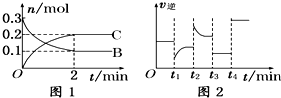 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )| A、t1时改变的条件可能是升高温度 |
| B、t2时改变的条件可能是增大B的浓度 |
| C、t3时改变的条件可能是加压,此时c(B)不变 |
| D、t4时可能是使用了催化剂,此时c(B)不变 |