题目内容
 醋酸是一种常见的弱酸.
醋酸是一种常见的弱酸.(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
(2)为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol?L-1与0.40mol?L-1的HCl溶液、0.20mol?L-1与0.40mol?L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol?L-1) | 醋酸浓度 (mol?L-1) | 实验目的 |
| a | 298 | 0.20 |  | Ⅰ.实验a和b是探究 Ⅱ.实验a和c是探究 Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
| b | 308 | 0.20 |  | |
| c | 298 | 0.40 |  | |
| d |  |  |
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)═Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1
②H2O(g)═H2(g)+
| 1 |
| 2 |
③Mg(s)+
| 1 |
| 2 |
则氢氧化镁分解的热化学方程式是
考点:弱电解质在水溶液中的电离平衡,热化学方程式,比较强弱电解质的实验
专题:化学反应中的能量变化,电离平衡与溶液的pH专题
分析:(1)醋酸溶液中氢氧根离子浓度很小,可以忽略不计,则溶液中c(H+)≈c(CH3COO-),电离平衡常数K=
;
(2)①根据实验的不同点确定其实验目的;
②Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别,则d实验温度是 298K、醋酸浓度为0.20mol/L,实验b、d温度不同,盐酸和醋酸浓度相等,该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,则实验b中反应速率是该图象中反应速率的2倍,d是反应速率是该图象中反应速率的
;
(3)根据盖斯定律进行书写.
| c(H+).c(CH3COO-) |
| c(CH3COOH) |
(2)①根据实验的不同点确定其实验目的;
②Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别,则d实验温度是 298K、醋酸浓度为0.20mol/L,实验b、d温度不同,盐酸和醋酸浓度相等,该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,则实验b中反应速率是该图象中反应速率的2倍,d是反应速率是该图象中反应速率的
| 1 |
| 2 |
(3)根据盖斯定律进行书写.
解答:
解:(1)醋酸溶液中氢氧根离子浓度很小,可以忽略不计,则溶液中c(H+)≈c(CH3COO-)=1.3×10-3 mol/L,电离平衡常数K=
=
mol/L=1.7×10-5mol/L,
答:c(CH3COO-)为1.3×10-3;其电离平衡常数为1.7×10-5mol/L;
(2)①Ⅰ.实验a和b的不同点是温度,所以其目的是探究温度对镁与盐酸反应速率的影响;
Ⅱ.实验a和c的不同点是浓度,所以其目的是探究浓度对镁与盐酸反应速率的影响,
故答案为:温度;浓度
②Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别,则d实验温度是 298K、醋酸浓度为0.20mol/L,实验b、d温度不同,盐酸和醋酸浓度相等,该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的
,则其反应时间是原来的2倍,则实验b中反应速率是该图象中反应速率的
倍,d是反应速率是该图象中反应速率的
,其反应时间是原来的2倍,
所以其图象为 ,故答案为:
,故答案为: ;
;
(3)①Mg(s)+2H2O(g)═Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1
②H2O(g)═H2(g)+
O2(g)△H2=+242kJ?mol-1
③Mg(s)+
O2(g)═MgO(s)△H3=-602kJ?mol-1.
将方程式③+②-①得Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81 kJ?mol-1,
故答案为:Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81 kJ?mol-1.
| c(H+).c(CH3COO-) |
| c(CH3COOH) |
| 1.3×10-3×1.3×10-3 |
| 0.10 |
答:c(CH3COO-)为1.3×10-3;其电离平衡常数为1.7×10-5mol/L;
(2)①Ⅰ.实验a和b的不同点是温度,所以其目的是探究温度对镁与盐酸反应速率的影响;
Ⅱ.实验a和c的不同点是浓度,所以其目的是探究浓度对镁与盐酸反应速率的影响,
故答案为:温度;浓度
②Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别,则d实验温度是 298K、醋酸浓度为0.20mol/L,实验b、d温度不同,盐酸和醋酸浓度相等,该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
所以其图象为
 ,故答案为:
,故答案为: ;
;(3)①Mg(s)+2H2O(g)═Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1
②H2O(g)═H2(g)+
| 1 |
| 2 |
③Mg(s)+
| 1 |
| 2 |
将方程式③+②-①得Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81 kJ?mol-1,
故答案为:Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81 kJ?mol-1.
点评:本题考查弱电解质的电离、探究外界条件对化学反应速率的影响、盖斯定律等知识点,知道弱电解质电离时其处理方法,会根据实验不同点确定实验目的,难点是绘画图象,题目难度中等.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
下列各项中,符合安全操作要求的是( )
| A、闻气体的气味时,用手轻轻在瓶口扇动,仅使极少量的气体飘进鼻孔 |
| B、为了操作方便,可以直接用手从试剂瓶中取出金属钠 |
| C、为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验 |
| D、稀释浓硫酸时,沿烧杯内壁将水缓缓加入浓硫酸中,并不断搅拌 |
下列化学性质中,烷烃不具备的是( )
| A、可以在空气中燃烧 |
| B、与C12发生取代反应 |
| C、可以与溴水中的溴反应而使溴水褪色 |
| D、不能使高锰酸钾溶液褪色 |
下列有关同分异构体数目的叙述中,不正确的是( )
| A、1-氯-1-丙烯可以形成顺反异构 |
B、与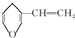 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
C、剧毒物质二恶英,其结构为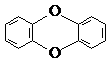 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种 |
| D、C11H16的苯的同系物中,经分析分子中除苯环外不含其他环状结构,还含有两个-CH3、两个-CH2-、一个-CH-,它的可能结构有4种 |
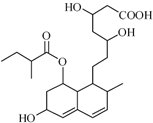 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A、能与FeCl3 溶液发生显色反应 |
| B、不能使酸性KMnO4 溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1 mol 该物质最多可与1 mol NaOH 反应 |
制造水泥和玻璃都需用到的原料是( )
| A、粘土 | B、石英 | C、石灰石 | D、纯碱 |
下列过程放出热量的是(1)铝放入盐酸中(2)水蒸气变成掖态水(3)氧分子变成氧原子(4)煅烧石灰石生成生石灰和二氧化碳( )
| A、(1)(2) |
| B、(3)(4) |
| C、(1)(3) |
| D、(2)(4) |