题目内容
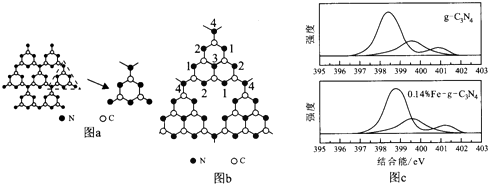
4.哈佛大学A.Y.Liu教授首次合成类金刚石相氮化碳(β--C3N4).福州大学王新晨教授在此基础上以单氰胺(CH2N2)为原料制得光催化剂类石墨相氮化碳(g-C3N4),其单层结构如图a,
(1)C、H,N元素电负性从大到小的顺序为N、C、H(填元素符号).
(2)β--C3N4熔点、硬度均高于金刚石,其原因为β--C3N4和金刚石都是原子晶体,C-N键长小于C-C,键能更大,熔点高硬度大.
(3)β--C3N4和g--C3N4中碳原子的杂化轨道类型分别为sp3、sp2.
(4)单氰胺的结构式为
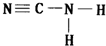 .
.(5)g--C3N4中存在的作用力为bce(填序号).
a.离子键 b.σ键 c.π键 d.氢键 e.范德华力
(6)g--C3N4中掺杂少量铁元素能提高光催化效果.图b为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图c中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
①Fe3+的价电子轨道表示式为
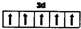 .
.②发生位移的谱线对应的N原子为1,2(填图b中的序号).
③谱线右移的原因为掺杂后Fe3+与N原子形成配位键,N原子周围的电子云密度降低,原子核对核外导致的束缚能力提高,0.14%Fe-g-C3N4样品中N-1s轨道结合能升高.
分析 (1)元素的非金属性越强,其吸引电子能力越强,则其电负性越大;
(2)原子晶体熔沸点、硬度与键长成反比;
(3)β--C3N4中C原子价层电子对个数是4、g--C3N4中碳原子价层电子对个数是3且不含孤电子对,根据价层电子对互称理论判断C原子杂化方式;
(4)单氰胺N原子形成3个共价键、H原子形成1个共价键、C原子形成4个共价键,据此书写其结构式;
(5)g--C3N4是分子晶体,非金属元素之间形成的共价单键为σ键、共价双键中一个是σ键、一个是π键,分子晶体中分子之间存在范德华力;
(6)①Fe原子失去3个电子生成Fe3+,其3d电子为价电子;
②Fe3+与N原子形成配位键导致谱线发生移动;
③Fe3+与N原子形成配位键,N原子周围的电子云密度降低,原子核对核外导致的束缚能力提高,样品中N-1s轨道结合能升高.
解答 解:(1)元素的非金属性越强,其吸引电子能力越强,则其电负性越大,这几种元素非金属性强弱顺序是N>C>H,所以电负性大小顺序是N>C>H,故答案为:N>C>H;
(2)原子晶体熔沸点、硬度与键长成反比,β--C3N4是原子晶体,C-N原子之间形成共价键,且C-N键长小于C-C,则键能更大、熔点高硬度大,
故答案为:β--C3N4和金刚石都是原子晶体,C-N键长小于C-C,键能更大,熔点高硬度大;
(3)β--C3N4中C原子价层电子对个数是4、g--C3N4中碳原子价层电子对个数是3且不含孤电子对,根据价层电子对互称理论判断C原子杂化方式分别为sp3、sp2,故答案为:sp3、sp2;
(4)单氰胺N原子形成3个共价键、H原子形成1个共价键、C原子形成4个共价键,据此书写其结构式为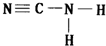 ,
,
故答案为: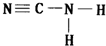 ;
;
(5)g--C3N4是分子晶体,非金属元素之间形成的共价单键为σ键、共价双键中一个是σ键、一个是π键,分子晶体中分子之间存在范德华力,C和N原子之间存在共价共价单键和共价双键,故选bce;
(6)①Fe原子失去3个电子生成Fe3+,其3d电子为价电子,其价电子轨道表示式为 ,
,
故答案为: ;
;
②Fe3+与N原子形成配位键导致谱线发生移动,而图中1,2号N原子含有对孤对电子,能形成配位键,
故答案为:1,2;
③掺杂后Fe3+与N原子形成配位键,N原子周围的电子云密度降低,原子核对核外导致的束缚能力提高,0.14%Fe-g-C3N4样品中N-1s轨道结合能升高,故谱线右移.
故答案为:掺杂后Fe3+与N原子形成配位键,N原子周围的电子云密度降低,原子核对核外导致的束缚能力提高,0.14%Fe-g-C3N4样品中N-1s轨道结合能升高.
点评 本题是对物质结构与性质的考查,涉及电负性、晶体类型与性质、化学键、核外电子排布、晶体结构等,(6)为易错点、难点,具有一定的区分度,是对学生综合能力的考查.

| A. | 标准状况下,0.5NA个Br2分子所占的体积为11.2 L | |
| B. | 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA | |
| C. | 标准状况下,6.72 L Cl2与足量的NaOH溶液反应,转移的电子数为0.3NA | |
| D. | 在0.1 mol•L-1NH4Cl溶液中阳离子的数目可能为NA |
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
实验流程如下:
金坷垃$→_{加热}^{辅助试剂}$(NH4)2SO4溶液$→_{吹出}^{NaOH}$NH3$→_{吸收}^{H_{3}BO_{3}}$(NH4)2B4O7溶液→用标准盐酸滴定
步骤:①取10.00g“金坷垃”尿素[CO(NH2)2]化肥溶于水,定容至100mL;
②在烧杯中加入10.00mL步骤①中得到的金坷垃水溶液和辅助试剂,加热充分反应;
③将反应液转移到大试管中;
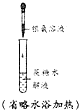
④按如图2装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
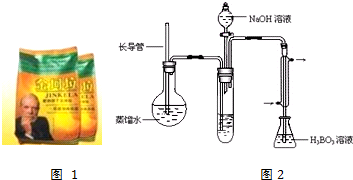
⑤取下锥形瓶,滴加指示剂,用0.2500mol•L-1盐酸标准液滴定;
⑥重复实验操作.
数据记录如表1:
表1
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.90 |
| 3 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 4 | x |
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为(NH4)2B4O7+2HCl+5H2O=4H3BO3+2NH4Cl.
(2)步骤③的实验装置中需要加热的仪器是圆底烧瓶(填仪器名称),长导管的作用是作为安全管,防止装置中压力过大而发生危险;防止冷却时发生倒吸.
(3)编号为4的实验应加入的样品和辅助试剂为10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸,理由是空白、等量对照以消除其他试剂、实验操作等因素引起的误差.
(4)通过计算可得“金坷垃”化肥中的氮含量为117.67-3.5x克/每千克化肥(用含x的代数式表示,要求化简).我国农业用尿素的标准为:
表2
| 级别 | 优等品 | 一等品 | 合格品 |
| 总尿素含量%≥ | 46.4 | 46.2 | 46.0 |
| A | B | C | D | |
| 装置 |  |  |  |  |
| 实验 | 从KI和I2的固体混合物中回收I2 | 分离混合体系中的Fe(OH)3沉淀和胶体 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离苯酚和水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好完全沉淀H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 用NaOH吸收少量二氧化硫 OH-+SO2═HSO3- | |
| C. | 氯化铝溶液中加过量氨水Al3++3NH3.H2O═Al(OH)3↓+3 NH4+ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳 ClO-+H2O+CO2═HCO3-+HClO |
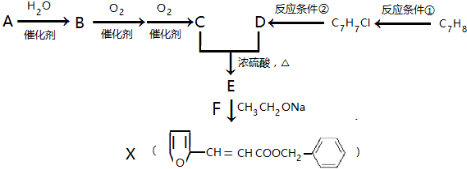
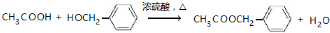
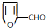 ,其最多有11个原子共平面.
,其最多有11个原子共平面.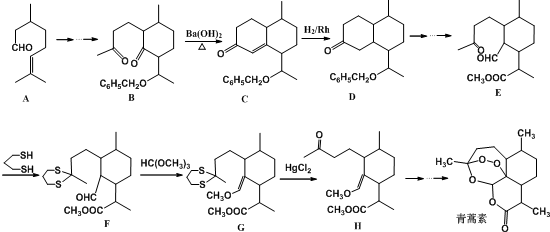
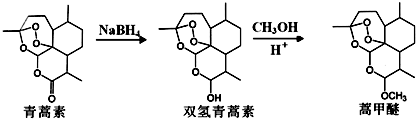
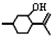 ,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成
,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成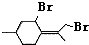 ,请写出相关化学反应方程式
,请写出相关化学反应方程式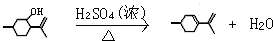 ,
,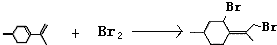 .
.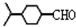 .(填结构简式)
.(填结构简式)