题目内容
7.下列反应的离子方程式不正确的是( )| A. | 向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好完全沉淀H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 用NaOH吸收少量二氧化硫 OH-+SO2═HSO3- | |
| C. | 氯化铝溶液中加过量氨水Al3++3NH3.H2O═Al(OH)3↓+3 NH4+ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳 ClO-+H2O+CO2═HCO3-+HClO |
分析 A.恰好完全沉淀时,氢氧化钡与硫酸氢钠的物质的量相等,氢氧根离子过量;
B.二氧化硫少量,反应生成亚硫酸根离子;
C.氨水为弱碱,二者反应生成氢氧化铝沉淀和氯化铵;
D.二氧化碳过量,反应生成碳酸氢钙和次氯酸.
解答 解:A.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好完全沉淀,二者的物质的量相等,反应的离子方程式为:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故A正确;
B.用NaOH吸收少量二氧化硫,反应生成亚硫酸根离子和水,正确的离子方程式为:2OH-+SO2═SO32-+H2O,故B错误;
C.氯化铝溶液中加过量氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.次氯酸溶液中通入过量二氧化碳,反应生成碳酸氢钙和次氯酸,反应的离子方程式为:ClO-+H2O+CO2═HCO3-+HClO,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
18.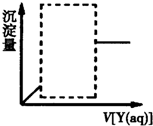 X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )
X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )
 X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )
X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
15.下列实验操作中所用仪器合理的是( )
| A. | 用100mL 量筒量取 5.2 mL 盐酸 | |
| B. | 用10mL 量筒量取 5.2 mL 盐酸 | |
| C. | 用托盘天平称取 25.02 g NaCl | |
| D. | 用广泛pH试纸测得某溶液的pH值为4.3 |
12.下列说法中,正确的是( )
| A. | 某气体能使品红溶液褪色,则该气体是SO2 | |
| B. | 向无色溶液中加入氯水后振荡,再加入CCl4振荡,下层显示紫红色,则原溶液中有I- | |
| C. | 向某溶液中加入硝酸酸化Ba(NO3)2溶液,产生白色沉淀,则原溶液中有SO42- | |
| D. | 向某溶液中加入NaOH,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有NH4+ |
19.下列说法中正确的是( )
| A. | 熵增加且放热的反应一定能自发进行 | |
| B. | 若可逆反应正、逆反应速率改变,则化学平衡一定发生移动 | |
| C. | 放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 | |
| D. | 若某化学平衡发生移动,则平衡混合体系的压强一定发生改变 |
16.下列属于氧化还原反应,且为吸热反应的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Zn+2H+=Zn2++H2↑ | D. | Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O |
 .
. .
.