题目内容
15.已知某离子反应为:8Fe2++NO3-+10H+=NH4++8Fe3++3H2O,下列说法不正确的是( )| A. | Fe2+为还原剂,NO3-被还原 | |
| B. | 消耗l mol氧化剂,转移电子8 mol | |
| C. | 氧化产物与还原产物的物质的量之比为1:8 | |
| D. | 若把该反应设计为原电池,则负极反应式为 Fe2+-e-=Fe3+ |
分析 反应方程式为8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、硝酸根离子是氧化剂,
A.该反应中亚铁离子是还原剂、硝酸根离子是氧化剂;
B.根据N元素化合价由+5价变为-3价,NO3-是氧化剂计算;
C.氧化剂对应的产物是还原产物,还原剂对应的产物为氧化产物;
D.若把该反应设计为原电池,负极上失电子发生氧化反应.
解答 解:A.该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以Fe2+为还原剂,NO3-是氧化剂被还原,故A正确;
B.N元素化合价由+5价变为-3价,NO3-是氧化剂,则消耗l mol氧化剂,转移电子l mol×(5+3)=8 mol,故B正确;
C.该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以Fe2+为还原剂,生成8Fe3+为氧化产物,NO3-是氧化剂,生成NH4+为还原产物,则氧化产物与还原产物的物质的量之比为8:1,故C错误;
D.若把该反应设计为原电池,负极上失电子发生氧化反应,电极反应式为Fe2+-e-=Fe3+,故D正确;
故选C.
点评 本题考查氧化还原反应,侧重考查学生分析、推断能力,抓住化合价变化是解题的关键,题目难度中等.

练习册系列答案
相关题目
5.原子序数依次增大的短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数.下列叙述正确的是( )
| A. | A元素形成的双原子分子A2最多有3种 | |
| B. | 化合物BC2的电子式为 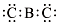 | |
| C. | B、C、D三种元素的非金属性强弱顺序为C>D>B | |
| D. | 化合物A2C的沸点高于A2D是因为C-A键比D-A键稳定 |
6.己知:100℃的溫度下,水的离子积Kw=1×10-12.下列说法正确的是( )
| A. | 0.05mol/L 的 H2SO4溶液 PH=1 | |
| B. | 0.001mol/L 的 NaOH溶液 PH=11 | |
| C. | 0.005mol/L的H2SO4溶液与0.0lmol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 | |
| D. | 完全中和PH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL |
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 制备单晶硅的过程中不发生氧化还原反应 | |
| B. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 氢氧化铝可作胃酸的中和剂 |
10.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的关系曲线,下列判断正确的是( )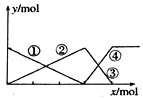

| A. | ①线表示AlO2-的物质的量的变化 | B. | x表示AlCl3的物质的量 | ||
| C. | ③线表示Al(OH)3的物质的量的变化 | D. | ④线表示AlO2-的物质的量的变化 |
20.下列有关实验说法正确的是( )
| A. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果△H偏小 | |
| B. | 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化 | |
| C. | 滴定管在装标准溶液前,必须先用待装标准溶液润洗 | |
| D. | NaHCO3溶液和稀盐酸可以用互滴的方法鉴别 |
18.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | B. | NH4+、Ba2+、OH-、NO3-(1:1:1:2) | ||
| C. | K+、H+、I-、AlO2-(1:1:1:1) | D. | Na+、Al3+、Cl-、OH-(4:1:4:3) |
