题目内容
化学能与电能是可以相互转化的.某同学用Fe、C做电极,探究CuCl2溶液电解时可生成Cu和Cl2.请根据如图回答.

(1)应选用装置 (填“甲”或“乙”).
(2)X电极的材料是 ,在X极观察到的现象是 .
(3)Y电极的名称是 ,电极反应式是 ,检验该电极反应产物的方法是 .
(4)若该同学选用另一装置进行实验, (填“能”或“不能”)达到实验目的.写出在该装置中发生反应的化学方程式 .

(1)应选用装置
(2)X电极的材料是
(3)Y电极的名称是
(4)若该同学选用另一装置进行实验,
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲为原电池装置,乙为电解池装置,探究CuCl2溶液电解时可生成Cu和Cl2,应选择乙,铁作阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,C为阳极,发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,以此解答该题.
解答:
解:(1)甲为原电池装置,乙为电解池装置,探究CuCl2溶液电解时可生成Cu和Cl2,应选择乙,故答案为:乙;
(2)电解时,X为阴极,析出铜,可观察到电极上附有紫红色的固体,则X应为铁,否则作阳极被氧化而不能生成氯气,
故答案为:Fe;电极上附有紫红色的固体;
(3)Y连接电源的正极,为电解池的阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,可用湿润的碘化钾淀粉试纸放在Y电极附近检验氯气,如试纸变蓝色,说明生成氯气.
故答案为:阳极;2Cl--2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
(4)如用甲装置,则不能实现题中涉及反应,原因是铁比铜活泼,可置换出铜,发生Fe+CuCl2=Cu+FeCl2,
故答案为:不能;Fe+CuCl2=Cu+FeCl2.
(2)电解时,X为阴极,析出铜,可观察到电极上附有紫红色的固体,则X应为铁,否则作阳极被氧化而不能生成氯气,
故答案为:Fe;电极上附有紫红色的固体;
(3)Y连接电源的正极,为电解池的阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,可用湿润的碘化钾淀粉试纸放在Y电极附近检验氯气,如试纸变蓝色,说明生成氯气.
故答案为:阳极;2Cl--2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
(4)如用甲装置,则不能实现题中涉及反应,原因是铁比铜活泼,可置换出铜,发生Fe+CuCl2=Cu+FeCl2,
故答案为:不能;Fe+CuCl2=Cu+FeCl2.
点评:本题考查了原电池和电解池原理,明确充放电时各个电极上发生的电极反应是解本题关键,难点是电极反应式的书写,要注意结合电解质溶液酸碱性书写,为易错点.

练习册系列答案
相关题目
下列关于放射性气体氡
Rn的说法正确的是( )
222 86 |
| A、质量数为222 |
| B、中子数为86 |
| C、质子数为136 |
| D、核电荷数为222 |
下列反应的离子方程式正确的是( )
A、向沸水中滴加饱和FeCl3溶液制备Fe(OH)3 胶体:Fe3++3H2O
| ||||
B、用小苏打治疗胃酸过多:HCO
| ||||
C、实验室用浓盐酸与MnO2制Cl2:MnO2+2H++2Cl-
| ||||
| D、将金属钠投入水中:Na+H2O=Na++OH-+H2↑ |
对于常温下0.1mol?L-1氨水和0.1mol?L-1醋酸,下列说法正确的是( )
| A、0.1mol?L-1氨水,溶液的pH=13 |
| B、0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
X、Y、Z、W是前20号元素,原子序数依次增大.X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫.下列说法错误的是( )
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: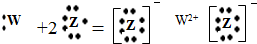 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |
 下表是在0.1MPa下,不同温度时,二氧化硫催化氧化成三氧化硫的平衡转化率(原料气成分的体积分数:SO27%,O211%,N282%):
下表是在0.1MPa下,不同温度时,二氧化硫催化氧化成三氧化硫的平衡转化率(原料气成分的体积分数:SO27%,O211%,N282%):