题目内容
如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物.它们之间存在如下关系(反应中生成的水及次要产物均已略去):
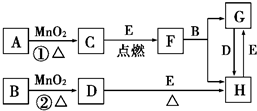
(1)写出下列物质的化学式:B ,E .
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂.
(3)若反应①是在加热条件下进行,则A是 (填化学式);若反应①是在常温条件下进行,则A是 (填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为 .

(1)写出下列物质的化学式:B
(2)指出MnO2在相关反应中的作用:反应①中是
(3)若反应①是在加热条件下进行,则A是
考点:无机物的推断
专题:推断题
分析:中学阶段与MnO2反应的制备的气体有O2和Cl2,F为有磁性的化合物,应为Fe3O4,则C为O2,E为Fe,D为Cl2,G为FeCl2,H为FeCl3,可知A为KClO3,B为浓盐酸,结合物质的性质以及题目要求可解答该题.
解答:
解:中学阶段与MnO2反应的制备的气体有O2和Cl2,F为有磁性的化合物,应为Fe3O4,则C为O2,E为Fe,D为Cl2,G为FeCl2,H为FeCl3,可知A为KClO3,B为浓盐酸,
(1)由以上分析可知B为HCl,E为Fe,故答案为:HCl;Fe;
(2)反应①中二氧化锰为催化剂,反应②浓盐酸和二氧化锰反应生成氯气和氯化锰,二氧化锰为氧化剂,故答案为:催化;氧化;
(3)若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A是H2O2,根据化合价变化判断,已知:2KClO3
2KCl+3O2↑,生成3mol转移12mol电子,2H2O2
2H2O+O2↑,生成3mol转移6mol电子,生成等物质的量的O2,反应中转移的电子数之比为2:1,
故答案为:KClO3;H2O2;2:1.
(1)由以上分析可知B为HCl,E为Fe,故答案为:HCl;Fe;
(2)反应①中二氧化锰为催化剂,反应②浓盐酸和二氧化锰反应生成氯气和氯化锰,二氧化锰为氧化剂,故答案为:催化;氧化;
(3)若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A是H2O2,根据化合价变化判断,已知:2KClO3
| ||
| △ |
| ||
故答案为:KClO3;H2O2;2:1.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,较为综合,该题的突破口为与二氧化锰的反应,学习中注意相关基础知识的积累.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
有A、B、C、D四种一元酸的溶液,实验表明:
①pH相同的A、C的溶液与足量的铁粉反应时,A溶液产生的氢气比C溶液产生的氢气要多;
②物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;
③酸A和D的钠盐反应生成A的钠盐和酸D.
由此可以确定四种酸的酸性由强到弱的顺序中正确的是( )
①pH相同的A、C的溶液与足量的铁粉反应时,A溶液产生的氢气比C溶液产生的氢气要多;
②物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;
③酸A和D的钠盐反应生成A的钠盐和酸D.
由此可以确定四种酸的酸性由强到弱的顺序中正确的是( )
| A、B>C>A>D |
| B、A>C>D>B |
| C、D>A>C>B |
| D、C>D>A>B |
下列说法正确的是( )
| A、粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属 |
| B、电解含Cu2+、Ag+的混合溶液,阴极先析出Ag,说明Ag+的还原性比Cu2+强 |
| C、反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 |
| D、常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA-的电离程度大于其水解程度 |
H、T、D、H+可以用来表示( )
| A、同一种原子 |
| B、化学性质不同的氢原子 |
| C、氢元素 |
| D、氢的四种核素 |


