题目内容
20.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,pH=2的1.0 L H2SO4溶液中含有H+的数目为0.02 NA | |
| B. | 0.5 mol雄黄(As4S4,所有原子都满足8电子结构,结构如图)含有NA个S-S键 | |
| C. | 39 g苯分子中共含6 NA个共价单键 | |
| D. | 向FeI2、NaBr的混合溶液中通入适量氯气,当有1 molFe2+被氧化时,该反应转移电子的数目至少为3 NA |
分析 A、依据溶液pH计算氢离子浓度结合溶液体积计算氢离子物质的量得到离子数;
B、依据所有原子都满足8电子结构分析,白球为硫,黑球为As,分子中不存在S-S化学键;
C、苯分子中是六个完全相同的特殊的化学键,含有留个C-H单键;
D、溶液中离子还原性顺序的:I->Fe2+,当有1mol Fe2+被氧化时,Cl2首先把2molI-转化成I2.
解答 解:A.pH=2,硫酸溶液中氢离子的浓度为0.01mol/L,则:0.01mol/L×1L=0.01mol,数目为0.01NA,故A错误;
B、所有原子都满足8电子结构分析,白球为硫,黑球为As,分子中不存在S-S化学键,故B错误;
C、39g苯的物质的量n=$\frac{39g}{78g/mol}$=0.5mol,而苯分子中存在六个介于双键和单键的键,无碳碳单键,但有6个C-H单键,故0.5mol苯中共3NA个共价单键,故C错误;
D、溶液中离子还原性顺序的:I->Fe2+>Br-,当有1mol Fe2+被氧化时,Cl2会首先将把2molI-转化成I2,转移2mol电子;Fe2+转化成Fe3+,转移1mol电子,而Br-不一定被氧化,所以至少转移3mol电子,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质结构分析判断,氧化还原反应反应顺序的分析计算,掌握基础是关键,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
7.要从含Al3+、Fe3+、Ba2+、Ag+的溶液中分别沉淀出Fe3+、Ba2+、Ag+,加入试剂的顺序正确的是( )
| A. | HCl、H2SO4、NaOH | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NH3•H2O | D. | HCl、NH3•H2O、H2SO4 |
8.下列变化属于化学变化的是( )
| A. | 酒精挥发 | B. | 干冰升华 | C. | 铁钉生锈 | D. | 石蜡融化 |
15.同温同压下,已知O2的密度为ρg•L-1,则Cl2的密度为( )
| A. | $\frac{71ρ}{32}$g•L-1 | B. | $\frac{32ρ}{71}$g•L-1 | C. | $\frac{32}{71ρ}$g•L-1 | D. | $\frac{71}{32ρ}$g•L-1 |
12.关于铯及其化合物的以下各说法中不正确的是( )
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
9.下列各组物质中,不能按图示关系一步完成转化的是( )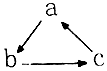

| A | B | C | D | |
| a | CO2 | Al(OH)3 | H2SO4 | HNO3 |
| b | Na2CO3 | NaAlO2 | SO2 | NO |
| c | NaHCO3 | Al2O3 | SO3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
8.3,3-二甲基-1-丁烯与氢气加成后得到的物质是( )
| A. | 2,2-二甲基-3-丁烷 | B. | 2,2-二甲基-2-丁烯 | ||
| C. | 2,2-二甲基-1-丁烯 | D. | 2,2-二甲基丁烷 |
 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题: