题目内容
15.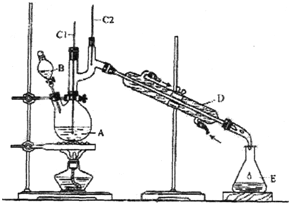 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.回答下列问题:
(1)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管;
(2)加入沸石的作用是防止暴沸;
(3)分液漏斗使用前必须进行的操作是c (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(5)反应温度应保持在90-95℃.其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(6)本实验中,正丁醛的产率为51%.
分析 (1)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加;
(3)带有活塞或瓶塞的装置使用前要检查是否漏水;
(4)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(5)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(6)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算.
解答 解:(1)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管,
故答案为:分液漏斗;直形冷凝管;
(2)加入沸石的作用是防止暴沸,
故答案为:防止暴沸;
(3)分液漏斗有上口塞子和下口有控制液体流量的活塞,在使用前需要检查是否漏水,故答案为:c;
(4)正丁醛密度为0.8017 g•cm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(5)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(6)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$=51%,
故答案为:51.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.

练习册系列答案
相关题目
19.下列说法中,错误的是( )
| A. | 乙烯的加成反应和乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关 | |
| B. | 相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 |
6.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是( )
| A. | K值不变,平衡一定不移动 | B. | K值变化,平衡一定移动 | ||
| C. | 平衡移动,K值一定变化 | D. | 平衡移动,K值一定不变化 |
3.下列有关化学用语表示正确的是( )
| A. | K+离子的结构示意图: | B. | 乙烯的比例模型: | ||
| C. | H2O2的电子式 | D. | CH4Si的结构式: |
20.将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
| A. | 硫酸、纯碱、小苏打 | B. | 磷酸、熟石灰、苛性钠 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 硫酸、烧碱、胆矾 |
4.常温下下列关于粒子浓度大小比较正确的是( )
| A. | pH=4的CH3COOH溶液和pH=10的KOH溶液等体积混合:2c(K+)+c(H+)=c(OH-)+c(CH3COOH)+2c(CH3COO-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3至溶液pH=7 (体积变化可忽略):c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 0.3mol的SO2通入1L0.4mol/L的NaOH溶液中:4c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3) | |
| D. | 0.1mol/L的HF溶液和0.1mol/L的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(H+)+c(F-) |
5.小李为了鉴别新买来的饮料不是牛奶而是豆浆,最好选用( )
| A. | 溴水 | B. | 氯水 | C. | 碘酒 | D. | 酒精 |
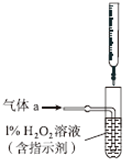 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题: