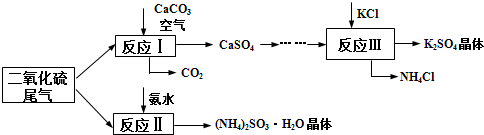
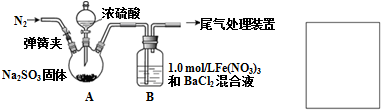
题目内容
1.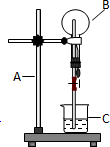 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液(1)请写出装置中A、B、C三仪器的名称A铁架台;B圆底烧瓶;C烧杯
(2)当打开弹簧夹,并挤压预先盛水的胶头滴管后,可以看到产生红色喷泉
(3)工业上制取盐酸的反应原理是H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
分析 (1)依据仪器形状说出气名称;
(2)氯化氢极易溶于水,氯化氢溶于水得到盐酸,盐酸具有酸性据此解答;
(3)工业上用在氯气中点燃氢气的方法制备氯化氢.
解答 解:(1)依据常见仪器的形状可知,装置中A、B、C三仪器的名称分别为:A铁架台;B圆底烧瓶;C烧杯;
故答案为:铁架台;圆底烧瓶;烧杯;
(2)氯化氢极易溶于水,氯化氢溶于水得到盐酸,盐酸具有酸性,能够使紫色石蕊试液变红色,所以当打开弹簧夹,并挤压预先盛水的胶头滴管后,可以看到产生红色喷泉;
故答案为:产生红色喷泉;
(3)氢气在氯气中燃烧生成氯化氢,方程式:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,
故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
点评 本题考查了氯化氢的工业制备性质,明确制备原理及喷泉实验原理、氯化氢的性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 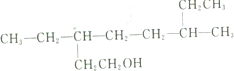 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 | B. | 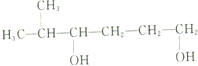 的名称为2-甲基-3,6-己二醇 的名称为2-甲基-3,6-己二醇 | ||
| C. | 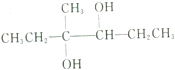 的名称为4-甲基-2,4-己二醇 的名称为4-甲基-2,4-己二醇 | D. | 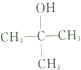 的名称为2-甲基-2-丙醇 的名称为2-甲基-2-丙醇 |
16.下列关于H2S分子的化学用语正确的是( )
| A. |  | B. |  | C. |  | D. | 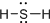 |
6.回答下列各问题:
(1)光谱证实单质Al与强碱溶液反应有[Al(OH)4]-生成,则[Al (OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C,Si,H的电负性由大到小的顺序为C>H>Si.
(3)Fe和Mn两元素的部分电离能数据如表:
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.其原因是Mn2+的3d轨道电子排布为半满状态较稳定;
(4)晶体熔点:MgO>CaO(填“>”、“<”或“=”),原因是MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以MgO熔点高
(5)H2S和H2O2的主要物理性质比较如下:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子间存在氢键,与水分子可形成氢键.
(1)光谱证实单质Al与强碱溶液反应有[Al(OH)4]-生成,则[Al (OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C,Si,H的电负性由大到小的顺序为C>H>Si.
(3)Fe和Mn两元素的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)晶体熔点:MgO>CaO(填“>”、“<”或“=”),原因是MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以MgO熔点高
(5)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
13.下列离子方程式正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO⒋↓ | |
| B. | 稀硫酸中加入铜片:Cu+2H+=Cu2++H2↑ | |
| C. | 氧化铜溶于盐酸:O2-+2H+=H2O | |
| D. | 二氧化碳通入足量澄清石灰水:Ca2++2OHˉ+CO2=CaCO3↓+H2O |
10.等质量的下列物质在常温常压下体积最大的是( )
| A. | 浓硫酸 | B. | CO2 | C. | 铁粉 | D. | 冰水混合物 |
11.已知:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ CH3CH2OH(g)+3H2O(g),某些化学键的键能数据如下表:
反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=-178 kJ•mol-1,△S<0(填>,<,=)
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |