题目内容
19.A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-的某一种.(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出.
根据(1)(2)实验事实可推断它们的化学式为:ABaCl2,BAgNO3,CCuSO4,DNa2CO3.
分析 A、B、C、D四种可溶性盐,则给出八种离子形成四种可溶性盐,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定,如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
解答 解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-,Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3;由于C盐是蓝色的,所以A为CuSO4;四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;D生成无色气体,则为二氧化碳,即D为Na2CO3,所以A为BaCl2,
根据分析可知,A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3,
故答案为:BaCl2;AgNO3;CuSO4;Na2CO3.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题侧重基础知识的考查,有利于提高学生的分析能力及逻辑推理能力.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
10.等质量的下列物质在常温常压下体积最大的是( )
| A. | 浓硫酸 | B. | CO2 | C. | 铁粉 | D. | 冰水混合物 |
11.已知:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ CH3CH2OH(g)+3H2O(g),某些化学键的键能数据如下表:
反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=-178 kJ•mol-1,△S<0(填>,<,=)
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
8.三种常见元素结构信息如下表,试根据信息回答有关问题:
(1)写出B原子的基态电子排布式1s22s22p63s23p4;
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N-N-H…O-O-H…N-O-H…O-;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图
可简单表示如图1:
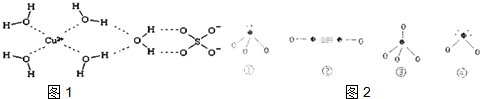
则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键F.非极性共价键
(5)下列分子结构图2中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N-N-H…O-O-H…N-O-H…O-;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图
可简单表示如图1:

则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键F.非极性共价键
(5)下列分子结构图2中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
9.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 在pH=1溶液中:NH4+、Fe2+、NO3-、Cl- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:AlO2-、K+、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
 2,3-二甲基-4-乙基辛烷.
2,3-二甲基-4-乙基辛烷. ,其分子空间构型是直线形.
,其分子空间构型是直线形.