题目内容
铅蓄电池广泛应用于机动车辆,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和氯化镁溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A、蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电解池的阴极反应式为:2H++2e-=H2↑ |
| C、电解过程中溶液中会产生白色沉淀现象 |
| D、蓄电池中每生成1molH2O,电解池中就消耗1molH2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铅蓄电池放电时,Pb为负极,被氧化生成PbSO4,电极反应式为Pb-2e-+SO42-=PbSO4,正极反应为PbO2+2e+4H++SO42-=PbSO4+2H2O,电池反应式为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
电解饱和氯化镁溶液时,阳极上氯离子离子放电,阴极上氢离子放电,以此解答该题.
电解饱和氯化镁溶液时,阳极上氯离子离子放电,阴极上氢离子放电,以此解答该题.
解答:
解:A.负极:Pb-2e-+SO42-=PbSO4,正极:PbO2+2e-+4H++SO4=PbSO4+2H2O,蓄电池放电时,每消耗0.1molPb,转移电子物质的量为0.2mol,正负极生成硫酸铅共0.2mol PbSO4,故A错误;
B.电极氯化镁溶液,阴极发生还原反应生成氢气,阴极反应式为:2H++2e-=H2↑,故B正确;
C.阴极生成氢气和OH-,可生成氢氧化镁沉淀,故C正确;
D.铅蓄电池为PbO2+Pb+2H2SO4=2PbSO4+2H2O,每生成1mol水转移电子1mol,电解池中阴极发生2H2O+2e-=H2↑+2OH-,通过1mol电子消耗1mol水,故D正确.
故选A.
B.电极氯化镁溶液,阴极发生还原反应生成氢气,阴极反应式为:2H++2e-=H2↑,故B正确;
C.阴极生成氢气和OH-,可生成氢氧化镁沉淀,故C正确;
D.铅蓄电池为PbO2+Pb+2H2SO4=2PbSO4+2H2O,每生成1mol水转移电子1mol,电解池中阴极发生2H2O+2e-=H2↑+2OH-,通过1mol电子消耗1mol水,故D正确.
故选A.
点评:本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的组成条件、工作原理以及电极方程式的书写,难度不大.

练习册系列答案
相关题目
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、向盐酸中滴加氨水的过程,可能满足c(H+)>c(NH4+) |
| B、0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、等浓度的NaClO、NaHCO3混合溶液中:c(Na+)=c(ClO?)+c(HClO)+c(HCO3-)+c(H2CO3)+c(CO32-) |
| D、浓度均为0.1mol/L的HA(一元弱酸)和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
| A、一定含有I-,不含有Cl- |
| B、可能含有Cl-、NO3-和I- |
| C、可能含有NO3- |
| D、一定不含有Fe3+ |
将如图所示实验装置的K闭合,下列判断错误的是( )
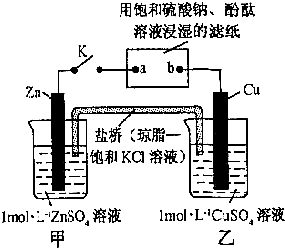

| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
下列离子方程式书写正确的是( )
| A、氨气通入醋酸溶液中:NH3+H+=NH4+ | ||||
B、用铜片作阴、阳极电解硝酸银溶液:4Ag++2H2O
| ||||
| C、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-═BaCO3↓+H2O | ||||
| D、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O══[Ag(NH3)2]++Cl-+2H2O |
“复盐”是指由多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2;而由一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl].下列化合物属于混盐的是( )
| A、CaOCl2 |
| B、(NH4)2Fe(SO4)2 |
| C、BiONO3 |
| D、K3[Fe(CN)6] |
下列图示与对应的叙述相符的是( )


| A、图1表示同温度下,Ph=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B、向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C、如图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为:c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D、用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
 ═□Mn2++□NO
═□Mn2++□NO