题目内容
9.常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液②pH=3的盐酸③PH=11的氨水④PH=11的NaOH溶液,下列说法正确的是( )| A. | ①和②混合溶液中:c(H+)不变 | |
| B. | ①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:溶质只有NH4Cl | |
| D. | ③和④分别用等浓度的盐酸中和,消耗盐酸的体积相同 |
分析 A、pH=3的CH3COOH溶液和pH=3的HCl溶液中c(H+)均为10-3mol/L;
B、醋酸是弱酸,不完全电离,故①中c(CH3COOH)>10-3mol/L,而NaOH为强碱,故④中c(NaOH)=10-3mol/L;
C、一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,而②中c(HCl)=10-3mol/L;
D、NaOH为强碱,故④中c(NaOH)=10-3mol/L;一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L.
解答 解:A、pH=3的CH3COOH溶液和pH=3的HCl溶液中c(H+)均为10-3mol/L,故两者混合后,c(H+)均为10-3mol/L,故A正确;
B、醋酸是弱酸,不完全电离,故①中c(CH3COOH)>10-3mol/L,而NaOH为强碱,故④中c(NaOH)=10-3mol/L,故两者混合后,根据物料守恒可知:c(Na+)<c(CH3COO-)+c(CH3COOH),故B错误;
C、一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,而②中c(HCl)=10-3mol/L,则两者混合后氨水过量,故所得溶液中除了
NH4Cl外,还有过量的氨水,故C错误;
D、NaOH为强碱,故④中c(NaOH)=10-3mol/L;一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,故③和④分别用等浓度的盐酸中和,消耗的盐酸②更多,故D错误.
故选A.
点评 本题考查了弱电解质溶液中的电离平衡应用,主要是强酸、弱酸、强碱、弱碱溶液稀释、pH的大小比较,弱电解质电离平衡的移动的判断.

 名校课堂系列答案
名校课堂系列答案| A. | Zn与硫酸铜 | B. | Cu与硝酸 | C. | Mg与盐酸 | D. | Al与氢氧化钠 |
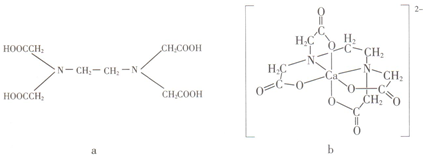
| A. | a和b中的N原子均为sp3杂化 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有分子内氢键 | D. | b含有共价键、离子键和配位键 |
| A. | 铜片消耗完所需时间 | B. | 反应生成的气体体积(标准状况下) | ||
| C. | 反应中氧化剂得到的电子总数 | D. | 反应后溶液中硝酸银离子的浓度 |
| 现象或事实 | 解释 | |
| A | 进行中和热测定时,将NaOH溶液一次性快速倒入盛有H2SO4的量热计中 | 减少热量散失,减少测量误差 |
| B | 加热滴有酚酞试剂的纯碱溶液,溶液红色变深 | 加热促进水的电离,溶液的碱性增强 |
| C | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀 | 生产的Al(OH)3胶体粒子带正电荷,发生定向移动 |
| D | 用FeCl3溶液制作印刷线路板 | FeCl3能从含有Cu2+的溶液中置换出Cu |
| A. | A | B. | B | C. | C | D. | D |
| A. | CaO | B. | S02 | C. | A1203 | D. | A1(0H)3 |
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大压强能加快反应速率 | D. | N2与H2能100%转化为NH3 |
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |