题目内容
4.天津港“8.12”特别重大爆炸事故教训深刻.氰化钠(N元素显-3价)属于剧毒化学品,处理氰化物的方法主要有两种:(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN-氧化成无污染的气体.请补充并配平该反应的离子方程式:CN-+OH-+Cl2═CO2+N2↑++10Cl-+H2O.处理35吨NaCN,理论上需要液氯126.8吨.
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑.检测水坑里氰化钠的浓度,取水样1ml,加入11ml1mol•L-1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L-1Na2S2O3溶液8.00ml(已知:实验中涉及的部分离子方程式为:2H++H2O2+2I-═I2+2H2O、I2+2S2O32-═2I-+S4O62-).请计算水坑里氰化钠的浓度.
分析 (1)氯气将CN-氧化成无污染的气体,反应生成二氧化氮、氮气,氯气被还原为离子,反应离子方程式为:2CN-+8OH-+5Cl2═2CO2+N2↑+10Cl-+4H2O,根据方程式计算需要氯气的质量;
(2)根据方程式计算反应后剩余H2O2的物质的量,再计算NaCN的物质的量,可得其浓度.
解答 解:(1)氯气将CN-氧化成无污染的气体,反应生成二氧化氮、氮气,氯气被还原为离子,反应离子方程式为:2CN-+8OH-+5Cl2═2CO2+N2↑+10Cl-+4H2O,
设处理35吨NaCN,理论上需要液氯x吨,则:
2NaCN+8NaOH+5Cl2═2CO2+N2↑+10NaCl+4H2O
98 355
35吨 x吨
所以98:355=35吨:x吨
解得x=126.8
故答案为:2CN-+8OH-+5Cl2═2CO2+N2↑+10Cl-+4H2O;126.8吨.
(2)滴定生成的碘,消耗为Na2S2O3为0.008L×0.25mol/L=2×10-3mol,
I2+2 S2O32-═2I-+S4O62-
1×10-3mol 2×10-3mol
2H++H2O2+2I-═I2+2H2O
1×10-3mol 1×10-3mol
即剩余过氧化氢为1×10-3mol,参加反应过氧化氢为0.011L×1mol/L-1×10-3mol=0.01mol,
NaCN+H2O2+H2O═NaHCO3+NH3↑
0.01mol 0.01mol
故c(NaCN)=$\frac{0.01mol}{0.001L}$=10mol/L,
答:水坑里氰化钠的浓度为10mol/L.
点评 本题考查化学方程式计算、物质含量测定、氧化还原反应配平,题目体现化学与生活实际联系,注意对基础知识理解掌握.

 小学课时特训系列答案
小学课时特训系列答案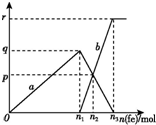 含有1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )
含有1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )| A. | a是Fe(NO3)2 | B. | n1=0.375 | C. | p=0.125 | D. | n2=0.30 |
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 氨气分子的电子式: | |
| C. | Cl-离子的结构示意图: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++${SO}_{4}^{2-}$ |
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在氧气中点燃细铁丝产生白色的烟 | |
| B. | 铁粉和硫粉混合加热生成黑色固体 | |
| C. | 纯铝在空气中放置会长出白毛 | |
| D. | 将铝片放入CuSO4溶液反应完全后,溶液由蓝色变为红色 |
| A. | 稀盐酸 | B. | FeCl3 | C. | Fe(NO3)3 | D. | BaCl2 |
| A. | SiO2 | B. | CO2 | C. | Cu | D. | KOH |
| A. | 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物 | |
| B. | 酸雨属空气污染,是指pH小于7的雨水,主要是人为的向大气中排放大量酸性物质造成的 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须回收处理 | |
| D. | 氯气是一种黄绿色、有毒气体,但可以用于自来水的杀菌消毒 |