题目内容
5.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )| A. | 电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少一点为3.2g | |
| B. | 0.5L1mol•L-1NaHS的溶液中,Na+和HS-离子数目之和为NA | |
| C. | 25℃时,7gC2H4和C2H6混合气体中,含有NA个C-H键 | |
| D. | 标况下,11.2L一氯甲烷中含有的氯原子数为0.5NA |
分析 A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属;
B.硫氢根离子为弱酸的酸式根离子,水溶液中部分水解;
C.C2H4和C2H6摩尔质量不同,1mo物质含有C-H键数目不同;
D.气体摩尔体积使用对象为气体.
解答 解:A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属,故当电路中通过0.1NA个电子时,阳极上减轻的质量小于3.2g,故A错误;
B.硫氢根离子为弱酸的酸式根离子,水溶液中部分水解,所以.5L1mol•L-1NaHS的溶液中,Na+和HS-离子数目之和小于NA,故B错误;
C.C2H4和C2H6摩尔质量不同,1mo物质含有C-H键数目不同,所以只知道混合气体质量,无法计算含有NA个C-H键,故C错误;
D.标况下,一氯甲烷为气体,11.2L一氯甲烷的物质的量为0.5mol,含有氯原子物质的量为0.5mol,故D 正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确物质的量、摩尔质量等化学量与阿伏加德罗常数的关系为解答关键,注意有机物结构特点,注意气体摩尔体积使用对象和条件,题目难度中等.

练习册系列答案
相关题目
20.某饱和一元醛和某饱和一元酮的混合物共6.0g,跟一定量的银氨溶液恰好完全反应后析出32.4g银.则在混合物中该醛的质量可能为( )
| A. | 1.2 g | B. | 2.2 g | C. | 4.0 g | D. | 4.6 g |
20.某有机物A是一种白色粉末,易溶于水,难溶于氯仿和苯,相对分子质量为174.取一定量的样品燃烧,产物只有CO2和H2O,且n(CO2):n(H2O)=7:5,消耗的O2和生成CO2的物质的量相等.
(1)A的分子式为C7H10O5.
(2)又知1molA能与足量的NaHCO3溶液反应生成22.4LCO2(标准状况),与足量的金属钠反应得到44.8LH2(标准状况),还能与Br2按物质的量之比1:1完全加成,根据上述信息,将A分子中含氧官能团的名称及数目填入下表(可不填满,也可补充).
(3)若有人认为A的结构简式可能为“ ”,你认为这种结构是否存在:是,该物质在一定条件下能(填“能”或“不能”)发生分子内的酯化反应,作出此判断的理由是含有羟基和羧基.
”,你认为这种结构是否存在:是,该物质在一定条件下能(填“能”或“不能”)发生分子内的酯化反应,作出此判断的理由是含有羟基和羧基.
(1)A的分子式为C7H10O5.
(2)又知1molA能与足量的NaHCO3溶液反应生成22.4LCO2(标准状况),与足量的金属钠反应得到44.8LH2(标准状况),还能与Br2按物质的量之比1:1完全加成,根据上述信息,将A分子中含氧官能团的名称及数目填入下表(可不填满,也可补充).
| 含氧官能团名称 | |||
| 含氧官能团数目 |
 ”,你认为这种结构是否存在:是,该物质在一定条件下能(填“能”或“不能”)发生分子内的酯化反应,作出此判断的理由是含有羟基和羧基.
”,你认为这种结构是否存在:是,该物质在一定条件下能(填“能”或“不能”)发生分子内的酯化反应,作出此判断的理由是含有羟基和羧基.
10.下列离子方程式正确的是( )
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水溶加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+═AgCl↓ | |
| D. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
14.进入化学实验室必须注意安全,下列说法不正确的是( )
| A. | 不慎将酸溅到眼里,应立即用水冲洗,边洗边眨眼 | |
| B. | 酒精着火时,可用湿抹布将其扑面 | |
| C. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯后点燃 | |
| D. | 稀释浓硫酸时,可先在量筒中加一定体积的水,再一边搅拌,一边慢慢加入浓硫酸 |
15.下列实验现象和结论相符的是( )
| A. | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定含有CO32- | |
| B. | 某溶液中加入硝酸银,产生白色沉淀,则溶液中一定含有Cl- | |
| C. | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色溶液中有Na+,无K+ | |
| D. | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴新制氯水,溶液变红溶液中一定含有Fe2+ |
 根据所学,回答下列问题:
根据所学,回答下列问题: <
<  (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同) <
<
 >CH3COOH.
>CH3COOH.
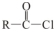 +R′OH→
+R′OH→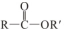 +HCl
+HCl
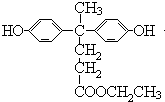 .
.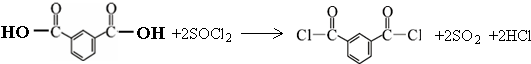 .
. 的路线.
的路线.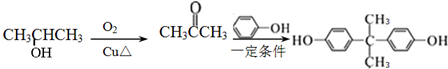 .
.