题目内容
10.下列离子方程式正确的是( )| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水溶加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+═AgCl↓ | |
| D. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.乙酸铵为易溶的强电解质,离子方程式中应该拆开;
B.苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠;
C.氯乙烷分子中不存在氯离子,该反应不会发生;
D.铝离子与氨水反应生成氢氧化铝沉淀.
解答 解:A.用银氨溶液检验乙醛中的醛基,正确的离子方程式为:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水溶加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故A错误;
B.苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,离子反应方程式为: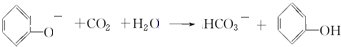 ,故B错误;
,故B错误;
C.由于氯酸钾不能电离出氯离子,则氯乙烷中滴入AgNO3溶液后没有明显现象,故C错误;
D.硫酸铝溶液中加入过量的氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
5.关于常温下pH=12的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | 氨水溶液的浓度等于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.01 mol•L-1 | |
| D. | 往等体积的两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小 |
1.下列有关化学用语表示正确的是( )
| A. | 漂白粉有效成分的化学式:Ca(ClO)2 | |
| B. | 亚硫酸的电离方程式:H2SO3═2H++SO32- | |
| C. | NO、NO2都是酸性氧化物 | |
| D. | Na+的结构示意图: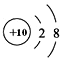 |
5.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少一点为3.2g | |
| B. | 0.5L1mol•L-1NaHS的溶液中,Na+和HS-离子数目之和为NA | |
| C. | 25℃时,7gC2H4和C2H6混合气体中,含有NA个C-H键 | |
| D. | 标况下,11.2L一氯甲烷中含有的氯原子数为0.5NA |
2.下表为几种短周期元素的性质:( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| B. | ③④处于同一周期 | |
| C. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
20.下列半径比较正确的是( )
| A. | Na、Mg、Ca原子半径从大到小 | B. | O2-、Na+、K+半径从小到大 | ||
| C. | Cl、Cl- 半径前者大 | D. | H、N、Al 半径从小到大 |
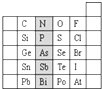 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.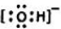 .
.