题目内容
5.下列叙述正确的是( )| A. | 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分的熔点都高 | |
| D. | 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰 |
分析 A.常温下,Al和.浓硫酸、浓硝酸发生钝化现象;
B.相同质量的Al分别与稀硫酸、NaOH溶液反应生成氢气一样多;
C.合金的熔沸点小于其各成分的熔沸点;
D.金属冶炼的本质是金属离子得电子被还原为单质,铝热反应常用于焊接铁轨,该反应中Al作还原剂,且反应为放热反应,用于提炼难熔金属.
解答 解:A.常温下,Fe、Al遇冷的浓硫酸发生钝化而阻止进一步反应,而不是不反应,故A错误;
B.足量的稀硫酸和氢氧化钠溶液,Al完全反应,根据转移电子守恒知,等质量的Al产生氢气相同,故B错误;
C.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金的熔点一般比组成它的各成分金属的熔点都低,故C错误;
D.用铝热剂冶炼难熔金属,与Al的还原性及放出大量的热有关,最主要是因为铝氧化时放出大量的热,可冶炼熔点较高的金属,如钒、铬、锰等,故D正确;
故选D.
点评 本题考查元素化合物性质,涉及金属冶炼、合金、方程式的计算、金属的性质等知识点,明确元素化合物性质及物质之间的转化是解本题关键,易错选项是B.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
5.化学方程式为3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O,下列说法中正确的( )
| A. | 反应中MnO2是氧化剂 | |
| B. | 该反应属于复分解反应 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
16.下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④19.6g H3PO4.
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④19.6g H3PO4.
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①④②③ |
13. 一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
 一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
20.如表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)第3周期中金属性最强的元素是钠(填“钠”或“镁”);
(2)S原子结构示意图为 ;钙离子的电子式为:Ca2+.
;钙离子的电子式为:Ca2+.
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;(填“H2S”或“HCl”)
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2;
(7)N元素形成的一种氢化物其水溶液呈碱性,请写出氢化物的化学式是NH3.
(8)铝是大自然赐予人类的宝物.它其中的一个用途是作为铝热剂,请写出铝和三氧化二铁发生反应的方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| 主族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)S原子结构示意图为
 ;钙离子的电子式为:Ca2+.
;钙离子的电子式为:Ca2+.(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;(填“H2S”或“HCl”)
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2;
(7)N元素形成的一种氢化物其水溶液呈碱性,请写出氢化物的化学式是NH3.
(8)铝是大自然赐予人类的宝物.它其中的一个用途是作为铝热剂,请写出铝和三氧化二铁发生反应的方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
10.下列实验设计能完成或实验结论合理的是( )
| A. | NH4Cl固体中混有少量的I2,可用加热的方法将I2除去 | |
| B. | 少量浓硝酸保存在无色细口瓶中 | |
| C. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
17.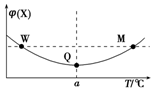 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数减小 | |
| B. | W、M两点Y的正反应速率相等 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | M点时,Y的转化率最大 |
12.以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
13.下列事实与胶体性质无关的是( )
| A. | 豆浆中加入CaSO4制豆腐 | |
| B. | 清晨在茂密的森林里看到缕缕阳光穿过林木枝叶 | |
| C. | FeCl3溶液中加入NaOH溶液产生红褐色沉淀 | |
| D. | 江河入海口常有三角洲形成 |