题目内容
18.As的原子结构示意图为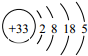 ,下列关于As的描述不正确的是( )
,下列关于As的描述不正确的是( )| A. | 位于第四周期,第ⅤA族 | B. | 属于非金属元素 | ||
| C. | 酸性:H3AsO4>H3PO4 | D. | 稳定性:AsH3<PH3 |
分析 A、周期数等于电子层数,主族元素最外层电子数等于主族序数;
B、硒是非金属元素;
C、非金属性越强最高价氧化物对应水化物的酸性越强;
D、非金属性越强氢化物越稳定.
解答 解:A、周期数等于电子层数,主族元素最外层电子数等于主族序数,电子层数是4,最外层5个电子,所以位于第四周期,第ⅤA族,故A正确;
B、硒是非金属元素,故B正确;
C、非金属性越强最高价氧化物对应水化物的酸性越强,非金属性:P>As,所以酸性:H3AsO4>H3PO4,故C错误;
D、非金属性越强氢化物越稳定,非金属性:P>As,所以稳定性:AsH3<PH3,故D正确;
故选C.
点评 本题考查元素周期律知识,侧重于学生的分析应用能力的考查,注意把握同主族元素化合物的性质的相似性与递变性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.化合物Ⅰ和H2O2在一定条件下发生化学反应可使荧光剂发出绿蓝色的光,化合物Ⅰ和H2O2反应生成香草醛和另一种小分子物质,该小分子物质是( )


| A. | H2O | B. | O2 | C. | CO2 | D. | CO |
13.某气态烃1mol能与2molHCl加成,所得的加成产物每摩尔又能与8molCl2反应,最后得到一种只含C、Cl两种元素的化合物,则气态烃为( )
| A. | 丙烯 | B. | 1-丁炔 | ||
| C. | 丁烯 | D. | 2-甲基-1,3-丁二烯 |
3.下列事实描述不正确的是( )
| A. | 高温煅烧石灰石的反应中,反应物总能量高于生成物总能量 | |
| B. | 中和反应中,反应物总能量高于生成物总能量 | |
| C. | 铝粉和盐酸反应时,溶液温度通常会上升 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应是吸热反应 |
10.目前世界上60%的镁是从海水中提取的.主要步骤如下: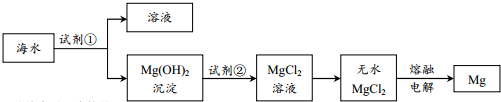
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳 | |
| B. | 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤 | |
| C. | 加入试剂②反应的离子方程式为:OH-+H+=H2O | |
| D. | 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子 |
7.常温下,下列有关溶液的说法正确的是( )
| A. | 向0.10mol•L-1NaHSO3溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO32-)>c(NH4+) | |
| B. | 0.1mol/L醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 已知Kw(HF)>Kw(CH3COOH),pH相等的NaF与CH3COOK两溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | 0.1mol•L-1醋酸溶液和0.2mol•L-1醋酸钠溶液等体积混合后的溶液中:3c(H+)+2c(CH3COOH)=c(CH3COO-)+3c(OH-) |
8.实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO42--2e-═PbSO4正极:PbO2+4H++SO42-+2e-═PbSO4+2H2O今欲制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.20 mol |
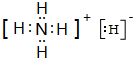 .
. 乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得.
乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得. 不稳定,会自动转化R-CH2CHO.请回答:
不稳定,会自动转化R-CH2CHO.请回答: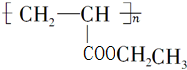 .
.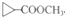 是D的一种同分异构体
是D的一种同分异构体