题目内容
16.下列有关说法正确的是( )| A. | 丙烯的结构简式为CH2CHCH3 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| D. | 键线式为 的有机物的分子式为C8H10 的有机物的分子式为C8H10 |
分析 A、烯烃中的碳碳双键不能省略;
B、新戊烷的二氯代物即是再用一个氯原子取代一氯新戊烷中的一个H原子;
C、CH4O一定为甲醇,而C2H6O可能为乙醇,还可能为二甲醚;
D、在键线式中,拐点和端点为碳原子,其余用H原子来补充.
解答 解:A、烯烃中的碳碳双键不能省略,故结构简式为CH2=CHCH3,故A错误;
B、新戊烷的二氯代物中,两个氯原子取代同一甲基的氢原子的同分异构体有1种,取代不同甲基的氢原子得到的二氯代物有1种,总共含有2种二氯代物,故B正确;
C、CH4O一定为甲醇,而C2H6O可能为乙醇,还可能为二甲醚,故两者不一定为同系物,故C错误;
D、在键线式中,拐点和端点为碳原子,其余用H原子来补充,故此有机物中含8个C原子,8个H原子,故分子式为C8H8,故D错误.
故选B.
点评 本题考查了有机物的结构简式的书写、同分异构体和同系物的判断等,难度不大,应注意基础的掌握.

练习册系列答案
相关题目
6.油脂的硬化是油脂进行了( )
| A. | 加成反应 | B. | 酯化反应 | C. | 氧化反应 | D. | 皂化反应 |
7.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18 g D2O所含的电子数为10NA | |
| B. | 12 g金刚石中含C-C键数为4NA | |
| C. | 标况下11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |
8.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀H2SO4反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 高温煅烧石灰石 | D. | 甲烷在O2中的燃烧反应 |
5.下列反应中水作还原剂的是( )
| A. | F2+H2O | B. | Cl2+H2O | C. | Na+H2O | D. | Na2O2+H2O |
6.有关元素X、Y、Z、D、E的信息如下:
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)比较Y与Z的氢化物的稳定性HCl>H2S(用化学式表示).
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是②③(填序号)
①通常实验室配制EY3溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式O2+2H2O+4e-=4OH-.
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)比较Y与Z的氢化物的稳定性HCl>H2S(用化学式表示).
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是②③(填序号)
①通常实验室配制EY3溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式O2+2H2O+4e-=4OH-.

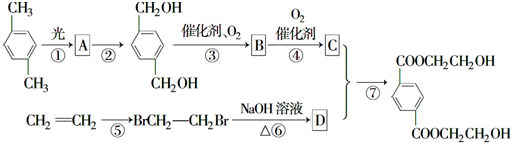
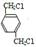 ,B
,B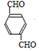 ,
,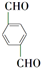 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$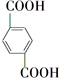
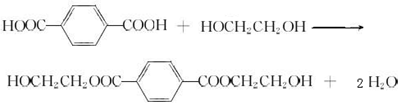
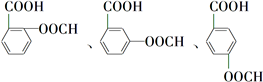 .
.