题目内容
2.单质可作为半导体材料的是硅(填名称);光导纤维主要成分化学式SiO2.分析 依据硅导电性介于导体与绝缘体之间,是良好的半导体材料;二氧化硅具有良好的光学特性解答.
解答 解:硅导电性介于导体与绝缘体之间,是良好的半导体材料,二氧化硅具有良好的光学特性,可以用来制造光导纤维,化学式:SiO2;
故答案为;硅;SiO2.
点评 本题考查了硅及其化合物用途,明确硅、二氧化硅的性质是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
12. 分子式为C12H24O2的酯,在一定条件下发生如图所示的转化,则符合上述条件的酯的结构可能有( )
分子式为C12H24O2的酯,在一定条件下发生如图所示的转化,则符合上述条件的酯的结构可能有( )
 分子式为C12H24O2的酯,在一定条件下发生如图所示的转化,则符合上述条件的酯的结构可能有( )
分子式为C12H24O2的酯,在一定条件下发生如图所示的转化,则符合上述条件的酯的结构可能有( )| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |
10.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目为0.0006NA | |
| B. | 常温下,1LpH=2的H2S溶液中H+的数目为0.01NA | |
| C. | 1mol铁粉与22.4L(标准状况)氯气充分反应,转移的电子数是3NA | |
| D. | 常温常压下,2.8gC4H8中有1.2NA的共价键 |
7.有机化合物的多样性给我们的生活带来了无限的发展空间,下列关于有机化合物知识当中的几个概念叙述错误的是( )
| A. | 在分子组成上相差一个或若干个CH2原子团的物质一定互称为同系物 | |
| B. | 具有同分异构现象的有机化合物互称为同分异构体 | |
| C. | 同素异形体是指同种元素形成不同的单质 | |
| D. | 含有相同的质子数而不同的中子数的同一类元素的原子互称为同位素 |
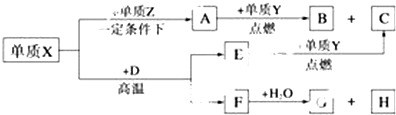
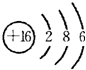 ,A的电子式
,A的电子式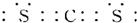 .
.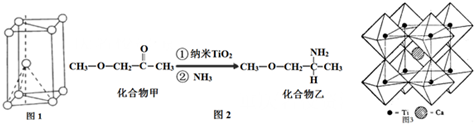


 .
.