题目内容
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):则下列分析都正确的组合是( )
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | 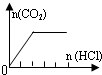 | c(Na+)=c(HCO3-) |
| B | NaHCO3、Na2CO3 | 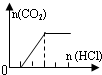 | c(CO32-)<c(HCO3-) |
| C | NaOH、Na2CO3 | 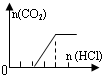 | c(OH-)>c(CO32-) |
| D | Na2CO3 | 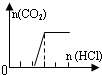 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A、A | B、B | C、C | D、D |
考点:离子方程式的有关计算
专题:计算题
分析:向一定量NaOH溶液的烧杯中通入不同量的CO2气体,当二氧化碳少量时,产物是NaOH和Na2CO3的混合物,当NaOH和CO2恰好完全反应时,产物只有Na2CO3的,当二氧化碳过量时,产物可能只有NaHCO3,也可能是Na2CO3和NaHCO3的混合物.根据产物和盐酸反应情况看与图象是否符合,根据水解比较离子浓度大小.
解答:
解:向一定量NaOH溶液的烧杯中通入不同量的CO2气体,当二氧化碳少量时,产物是NaOH和Na2CO3的混合物,当NaOH和CO2恰好完全反应时,产物只有Na2CO3的,当二氧化碳过量时,产物可能只有NaHCO3,也可能是Na2CO3和NaHCO3的混合物.
A、图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3,由于碳酸氢根水解,故c(Na+)>c(HCO3-),故A错误;
B、从图中看出刚滴下去盐酸一个单位后产生了二氧化碳,说明此时碳酸根的量是一个单位(盐多酸少,碳酸钠和盐酸一比一反应生成碳酸氢钠),后来盐酸加了两个单位才把所有二氧化碳反应出来,说明溶液中总的碳酸氢根量为两个单位,但有一个单位的是之前碳酸根得来的,所以原溶液中碳酸根的量和碳酸氢根的量相等,由于碳酸钠水解程度大于碳酸氢钠,故c(CO32-)<c(HCO3-),故B正确;
C、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明产物是NaOH和Na2CO3的混合物,一个单位的盐酸和NaOH反应,第二个单位的盐酸和Na2CO3反应生成NaHCO3,后由图中可看出,NaHCO3又消耗了2个单位的盐酸,不可能存在此种情况,故C错误;
D、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,且产生二氧化碳所消耗的盐酸是一个单位,不可能只有Na2CO3,故D错误;
故选B.
A、图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3,由于碳酸氢根水解,故c(Na+)>c(HCO3-),故A错误;
B、从图中看出刚滴下去盐酸一个单位后产生了二氧化碳,说明此时碳酸根的量是一个单位(盐多酸少,碳酸钠和盐酸一比一反应生成碳酸氢钠),后来盐酸加了两个单位才把所有二氧化碳反应出来,说明溶液中总的碳酸氢根量为两个单位,但有一个单位的是之前碳酸根得来的,所以原溶液中碳酸根的量和碳酸氢根的量相等,由于碳酸钠水解程度大于碳酸氢钠,故c(CO32-)<c(HCO3-),故B正确;
C、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明产物是NaOH和Na2CO3的混合物,一个单位的盐酸和NaOH反应,第二个单位的盐酸和Na2CO3反应生成NaHCO3,后由图中可看出,NaHCO3又消耗了2个单位的盐酸,不可能存在此种情况,故C错误;
D、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,且产生二氧化碳所消耗的盐酸是一个单位,不可能只有Na2CO3,故D错误;
故选B.
点评:本题考查学生金属钠的化合物的性质,题目难度中等,可根据碳酸钠、碳酸氢钠、氢氧化钠分别与盐酸反应的化学方程式及盐类的水解进行判断.

练习册系列答案
相关题目
下列实验操作中错误的是( )
| A、在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌 |
| B、用药匙或者纸槽把粉末状药品送入试管的底部 |
| C、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
| D、刚完成蒸发结晶,因要做下一个实验,可以将蒸发皿先放在桌面上,冷却后收好 |
下列说法正确的是( )
| A、常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 |
| B、浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 |
| C、碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
现有一瓶乙二醇和丙三醇的均匀混合物,已知它们的性质如下表.据此,将乙二醇和丙三醇互相分离的最佳方法是( )
| 物质 | 分子式 | 熔点(0C) | 沸点(0C) | 密度(g.cm-3) | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和酒精 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能与水酒精任意比互溶 |
| A、用水萃取出混和物中的丙三醇,再分液 |
| B、将混合物直接分液 |
| C、蒸馏法 |
| D、结晶法 |
将4mol A(g)和2mol B(g)在2L容器内混合,在一定条件下反应:2A(g)+B(g)?2C(g)若经2s后测得C的浓度为0.6mol/L现在下列几种说法,其中正确的是( )
(1)用物质A表示的反应的平均速率为0.3mol/(L?s)
(2)用物质B表示的反应的平均速率为0.6mol/(L?s)
(3)2s时物质A转化率为15%
(4)2s时物质B的浓度为0.7mol/L.
(1)用物质A表示的反应的平均速率为0.3mol/(L?s)
(2)用物质B表示的反应的平均速率为0.6mol/(L?s)
(3)2s时物质A转化率为15%
(4)2s时物质B的浓度为0.7mol/L.
| A、(1)(3) |
| B、(1)(4) |
| C、(1)(3)(4) |
| D、(2)(3)(4) |
已知反应H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ?mol-1,则反应HCl(g)=
H2(g)+
Cl2(g)的△H为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、+184.6 kJ?mol-1 |
| B、-92.3 kJ?mol-1 |
| C、-369.2 kJ?mol-1 |
| D、+92.3 kJ?mol-1 |
下列溶液中物质的量浓度肯定为1mol/L的是( )
| A、将40g NaOH固体溶解于1L水中 |
| B、将22.4L氯化氢气体溶于水配成1L溶液 |
| C、将1L 10 mol/L浓盐酸与10L水混合 |
| D、10g NaOH固体溶解在水中配成250mL溶液 |
某同学用托盘天平称量镁粉25.2g(1g以下用游码),他把镁粉放在左盘,当天平平衡时,所称取的镁粉的实际质量是( )
| A、25.2g |
| B、24.8g |
| C、24.2g |
| D、25.8g |