题目内容
下表为元素周期表的一部分,请参照元素A-H在表中的位置,用化学用语回答下列问题:
(1)上述元素中非金属性最强的元素是 ,金属性最强的是 .
(2)B、C、H的最高价含氧酸的酸性由强到弱的顺序是 .D、E、F的原子半径由大到小的顺序为 .
(3)上述一元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式 ;
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,回答下列问题:
①写出物质Y的电子式 ,
②写出Z与Y反应的化学方程式 ;
(5)用电子式表示C原子形成单质的过程 .
(6)写出C元素最高价氧化物对应的水化物浓溶液与铜反应的离子方程式: .
| 族 周期 |
IA | 0 | ||||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | B | C | D | E | ||||||
| 3 | F | G | H | |||||||
(2)B、C、H的最高价含氧酸的酸性由强到弱的顺序是
(3)上述一元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,回答下列问题:
①写出物质Y的电子式
②写出Z与Y反应的化学方程式
(5)用电子式表示C原子形成单质的过程
(6)写出C元素最高价氧化物对应的水化物浓溶液与铜反应的离子方程式:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,A、B、C、D、E、F、G、H分别是H、C、N、O、F、Na、Al、Si元素,
(1)上述元素中非金属性最强的元素在周期表的右上角,金属性最强的元素在周期表的左下角;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强;
原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小;
(3)两性氧化物是Al2O3,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,则该元素是O元素,O元素能与H元素形成原子个数比为1:1和1:2的两种共价化合物X、Y,X是H2O2、Y是H2O,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,该元素是Na元素,Z是Na2O2、M是Na2O;
(5)两个氮原子之间通过共用3对电子形成氮气分子;
(6)C元素最高价氧化物对应的水化物浓溶液是浓硝酸,浓硝酸与铜反应生成硝酸铜、二氧化氮和水.
(1)上述元素中非金属性最强的元素在周期表的右上角,金属性最强的元素在周期表的左下角;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强;
原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小;
(3)两性氧化物是Al2O3,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,则该元素是O元素,O元素能与H元素形成原子个数比为1:1和1:2的两种共价化合物X、Y,X是H2O2、Y是H2O,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,该元素是Na元素,Z是Na2O2、M是Na2O;
(5)两个氮原子之间通过共用3对电子形成氮气分子;
(6)C元素最高价氧化物对应的水化物浓溶液是浓硝酸,浓硝酸与铜反应生成硝酸铜、二氧化氮和水.
解答:
解:根据元素在周期表中的位置知,A、B、C、D、E、F、G、H分别是H、C、N、O、F、Na、Al、Si元素,
(1)上述元素中非金属性最强的元素在周期表的右上角,金属性最强的元素在周期表的左下角,所以这几种元素中,非金属性最强的是F元素、金属性最强的元素是Na元素,故答案为:F;Na;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强,这几种元素的非金属性强弱顺序是N>C>Si,属于其最高价含氧酸的酸性强弱顺序是HNO3>H2CO3>H2SiO3;
原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这三种原子半径大小顺序是Na>O>F;
故答案为:HNO3>H2CO3>H2SiO3;Na>O>F;
(3)两性氧化物是Al2O3,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,则该元素是O元素,O元素能与H元素形成原子个数比为1:1和1:2的两种共价化合物X、Y,X是H2O2、Y是H2O,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,该元素是Na元素,Z是Na2O2、M是Na2O;
①Y为H2O,其电子式为 ,故答案为:
,故答案为: ;
;
②Y是H2O、Z是Na2O2,二者反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(5)两个氮原子之间通过共用3对电子形成氮气分子,氮气分子的形成过程为 ,故答案为:
,故答案为: ;
;
(6)C元素最高价氧化物对应的水化物浓溶液是浓硝酸,浓硝酸与铜反应生成硝酸铜、二氧化氮和水,离子反应方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(1)上述元素中非金属性最强的元素在周期表的右上角,金属性最强的元素在周期表的左下角,所以这几种元素中,非金属性最强的是F元素、金属性最强的元素是Na元素,故答案为:F;Na;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强,这几种元素的非金属性强弱顺序是N>C>Si,属于其最高价含氧酸的酸性强弱顺序是HNO3>H2CO3>H2SiO3;
原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这三种原子半径大小顺序是Na>O>F;
故答案为:HNO3>H2CO3>H2SiO3;Na>O>F;
(3)两性氧化物是Al2O3,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,则该元素是O元素,O元素能与H元素形成原子个数比为1:1和1:2的两种共价化合物X、Y,X是H2O2、Y是H2O,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z、M,该元素是Na元素,Z是Na2O2、M是Na2O;
①Y为H2O,其电子式为
 ,故答案为:
,故答案为: ;
;②Y是H2O、Z是Na2O2,二者反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(5)两个氮原子之间通过共用3对电子形成氮气分子,氮气分子的形成过程为
 ,故答案为:
,故答案为: ;
; (6)C元素最高价氧化物对应的水化物浓溶液是浓硝酸,浓硝酸与铜反应生成硝酸铜、二氧化氮和水,离子反应方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及氧化还原反应、电子式、离子反应等知识点,根据物质的性质、离子反应特点、元素周期律等知识点来分析解答,熟练掌握并灵活运用基础知识解答问题,题目难度不大.

练习册系列答案
相关题目
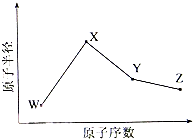 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大. 某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:
某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题: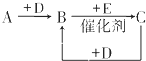 A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).