题目内容
17.甲、乙、丙三位同学分别用如图三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题: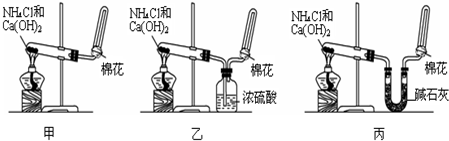
(1)三位同学制取氨气的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是BD(双选)
A、氨气难溶于水 B、氨气极易溶于水 C、氨气密度比空气大
D、氨气密度比空气小 E、氨气密度比水大 F、氨气密度比水小
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是乙(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,说明原因2NH3+H2SO4=(NH4)2SO4(用化学方程式表示).
(4)检验氨气是否收集满的方法是C
A、闻到有氨气逸出 B、棉花被气体冲出
C、用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D、用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是丙(填“甲”、“乙”或“丙”).
分析 (1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)氨气能与硫酸反应而被硫酸吸收;
(4)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性;
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,可以用碱石灰除杂.
解答 解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,故选:BD,
故答案为:BD;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,乙收集不到氨气,反应方程式为:2NH3+H2SO4=(NH4)2SO4,
故答案为:乙;氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收;2NH3+H2SO4=(NH4)2SO4;
(4)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,故选:C;
(5)碳酸氢铵受热分解生成氨气、水和二氧化碳.甲收集到的是混合气体,得不到纯净氨气,乙分解得到二氧化碳、氨气和水蒸气通过浓硫酸氨气被吸收得不到氨气,丙分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气,故答案为:丙.
点评 本题考查了氨气的制取、干燥及收集,根据氨气的性质选取干燥剂,根据氨气的溶解性及密度确定收集方法,知道形成喷泉实验的条件,并不是只有氨气才能形成喷泉实验,难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | ClCH2CH═CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2═CHCH3+Cl2→CH2ClCHClCH3 | |
| C. |  | |
| D. |  |
| A. | NO3-、AlO2-、K+、Na+ | B. | Ba2+、NH4+、Cl-、NO3- | ||
| C. | Mg2+、SO42-、K+、NO3- | D. | Fe2+、Al3+、Cl-、SO42- |
 2010年12月,一个小学生关于对漂白蘑菇的调查再次引发了人们对滥用漂白剂漂白食品的担忧.曾有不良商贩用过氧化氢漂白食品的记录.下列有关过氧化氢(图是过氧化氢的分子结构)的说法,正确的是( )
2010年12月,一个小学生关于对漂白蘑菇的调查再次引发了人们对滥用漂白剂漂白食品的担忧.曾有不良商贩用过氧化氢漂白食品的记录.下列有关过氧化氢(图是过氧化氢的分子结构)的说法,正确的是( )| A. | 过氧化氢是离子化合物 | |
| B. | 过氧化氢分子既含有非极性键又含有极性键 | |
| C. | 过氧化氢分子只含有极性键 | |
| D. | 过氧化氢分子只含有非极性键 |
| A. | 200mL 0.1mol/L NH4Cl溶液 | B. | 50mL 0.2mol/L NH4NO3溶液 | ||
| C. | 100mL 0.2mol/L NH3•H2O溶液 | D. | 100mL 0.2mol/L (NH4)2SO3溶液 |
| A. | 4.4 g二氧化碳含有的分子数为0.1NA | |
| B. | 锌从盐酸中置换出1 mol H2,电子转移数为NA | |
| C. | 常温常压下,11.2 L氧气含有的原子数为NA | |
| D. | 1 mol•L-1CaCl2溶液中含有的氯离子数为2NA |
 ,则该有机物核磁共振氢谱有3个峰.
,则该有机物核磁共振氢谱有3个峰.