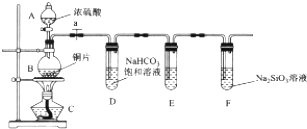
题目内容
5.下列离子方程式正确的是( )| A. | 向醋酸中滴加氢氧化钠:H++OH-=H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Ca(HCO3)2溶液与少量KOH溶液反应Ca2++HCO3-+OH-=H20+CaCO3↓ | |
| D. | 向Na2SO3溶液中通入少量氯气:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ |
分析 A.醋酸为弱酸,应保留化学式;
B.三价铁离子具有强的氧化性,能够氧化碘离子;
C.氢氧化钾少量,反应生成碳酸钙、碳酸氢钠和水;
D.氯气少量,反应生成硫酸钠、氯化钠和亚硫酸氢钠.
解答 解:A.向醋酸中滴加氢氧化钠:CH3COOH+OH-=H2O+CH3COO-,故A错误;
B.氢氧化铁溶于氢碘酸中的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故B错误;
C.Ca(HCO3)2溶液与少量KOH溶液反应,离子方程式:Ca2++HCO3-+OH-=H20+CaCO3↓,故C正确;
D.向Na2SO3溶液中通入少量氯气:3SO32-+Cl2+H2O=SO42-+2Cl-+2HSO3-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
18.由A、B、C、D四种金属按表中装置图进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
| 装置 | 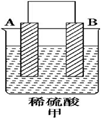 |  | 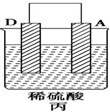 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
15.下列反应的离子方程式书写不正确的是( )
| A. | 镁条与稀盐酸反应:Mg+2H+═H2↑+Mg 2+ | |
| B. | 铝丝与硫酸铜溶液反应:Al+Cu 2+═Al 3++Cu | |
| C. | 铜丝与硝酸银溶液反应:Cu+2Ag+═2Ag+Cu 2+ | |
| D. | 锌和氯化铜溶液反应:Zn+Cu2+═Zn 2++Cu |
2.下列转变需加入还原剂的是( )
| A. | Fe2+→Fe3+ | B. | Cl-→Cl2 | C. | Mg(OH)2→MgO | D. | MnO4-→MnO2 |
10.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X、Y、Z三种元素的单质中,Z单质的氧化性最强 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
17.下列物质属于电解质的是( )
| A. | 氯化钠溶液 | B. | 氨水 | C. | 硝酸钾 | D. | 铝制导线 |
14.两份质量相同的CH4和NH3比较,下列结论错误的是( )
| A. | 分子个数比为17:16 | |
| B. | 同温同压下两种气体的体积之比是17:16 | |
| C. | 氢原子个数比为17:12 | |
| D. | 原子个数比为17:16 |
15.已知 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | M的分子式为C6H10 | |
| B. | N能发生氧化反应和取代反应 | |
| C. | N的含有相同官能团的同分异构体有8种(不考虑立体结构) | |
| D. | M中所有碳原子在同一平面上 |